
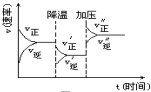
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
分析 由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此可解答该题.
解答 解:A、由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,则A错误;
B、由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,则B正确;
C、增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,
若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,若A、B是气体,则D是液体或固体,增大压强平衡向正反应方向移动,则C错误,
D、增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,
若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,若A、B是气体,则D是液体或固体,增大压强平衡向正反应方向移动,则D错误.
故选B.
点评 本题考查化学反应速率与化学平衡的图象问题,根据温度、压强对反应速率的影响判断平衡移动的方向是解答该题的关键,注意压强对平衡移动的影响与化学计量数的关系,为易错点,题目难度中..


科目:高中化学 来源: 题型:实验题
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 氯水和活性炭使红墨水褪色 | |
| C. | 漂白粉和钠长期暴露在空气中变质 | |
| D. | 氯水和过氧化钠使品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体碳酸钠 | B. | 食醋 | C. | 白酒 | D. | 白糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com