
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.常温下,100g46%乙醇水溶液中含有H原子数为12 NA
B.23gNa与足量O2反应,生成Na2O 和Na2O2的混合物,转移的电子数为 NA
C.标准状况下,2.24 LCCl4含有的共价键数为0.4 NA
D.1 molN2与4molH2反应生成的NH3分子数小于2 NA
【答案】C
【解析】解:A、在乙醇水溶液中,除了乙醇含有H原子,水也含H原子,100g46%的乙醇水溶液中含有的乙醇的物质的量n= ![]() =1mol,含6molH原子;水的物质的量n=
=1mol,含6molH原子;水的物质的量n= ![]() =3mol,故含6molH原子,故此溶液中共含12NA个H原子,故A正确;
=3mol,故含6molH原子,故此溶液中共含12NA个H原子,故A正确;
B、23g钠的物质的量为1mol,而钠反应后无论产物是氧化钠还是过氧化钠,均由0价变为+1价,故1mol钠失去NA个电子,与产物无关,故B正确;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的共价键的个数,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子个数小于2NA个,故D正确.
故选C.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是( )
A. 酯化反应的产物只有酯 B. 酯化反应可看成取代反应的一种
C. 酯化反应是有限度的 D. 浓硫酸可做酯化反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.在任何物质分子中都含有化学键
B.HF、HCl、HBr、HI的沸点依次升高
C.D2O分子与H2O分子是所含电子总数不相等的分子
D.CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途或变化,说法正确的是 ( )
A.碳酸钠是发酵粉的主要成分B.次氯酸钙是漂白粉的有效成分
C.SO2有漂白性可以用来漂白面条等食品D.N2与O2在放电条件下直接化合生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( )
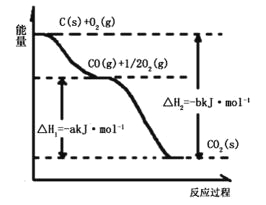
A.碳的燃烧热为bkJ/mol
B.2C(s)+O2(g)=2CO(g)△H=-2(b-a)kJ/mol
C.2CO2(s)=2CO(g)+O2(g)△H=+akJ/mol
D.C(s)+O2(g)=CO2(g)△H<-bkJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016盐城三模】实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
已知:①I2+Na2CO3═NaI+NaIO+CO2↑;△H<0
3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0
②I2(s)+I﹣(aq)═I3﹣(aq);
③水合肼(N2H4H2O)具有强还原性,可分别将IO﹣、IO3﹣和I2还原为I﹣,本身被氧化为N2(放热反应);100℃左右水合肼分解为氮气和氨气等.
(1)常温常压时,I2与Na2CO3溶液反应很慢,下列措施能够加快反应速率的是 (填字母).
a.将碘块研成粉末 b.起始时加少量NaI
c.将溶液适当加热 d.加大高纯水的用量
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,除防止反应速率过快,另一个原因是 .
(3)加入稍过量水合肼发生反应的离子方程式为 (只写一个).
(4)整个实验过程中都需要开动搅拌器,其目的是 .
(5)反应的后期I2与Na2CO3溶液反应难以进行,此阶段需对投料顺序作适当改进,改进的方法是 .
(6)所得溶液(偏黄,且含少量SO42﹣,极少量的K+和Cl﹣)进行脱色、提纯并结晶,可制得高纯NaI晶体.实验方案为:在溶液中加入少量活性炭煮沸、
(实验中需使用的试剂有:HI溶液,Na2CO3溶液、Ba(OH)2溶液、高纯水及pH试纸;除常用仪器外须使用的仪器有:真空干燥箱)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017宝山区二模】氮的单质及其化合物性质多样,用途广泛.
完成下列填空.
(1)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)
2CO2+N2+Q(Q>0)
某温度下测得该反应在不同时间的CO浓度如表:
时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
该反应平衡常数K的表达式为 ;温度升高,K值 (选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)= ;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)工业合成氨的反应温度选择500℃左右的原因是 .
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 .
a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是 ;在通入NH3的过程中溶液的导电能力 (选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com