
【题目】工业上可采用湿法技术从废印刷电路板中回收纯铜,其流程简图如下:
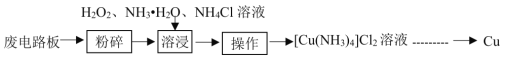
回答下列问题:
(1)开始时,将废电路板“粉碎”的目的是__________。“操作”的名称是_________________。
(2)某化学兴趣小组同学为探究“溶浸”过程中反应的实质,采用如图所示的装置,设计了如下对照实验。
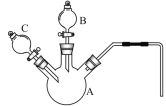
序号 | 实验名称 | 实验步骤 | 实验现象 | |
Ⅰ | 将铜片置于H2O2溶液中 | 先向A中加入0.5g光亮的铜片,再通过B加入30%的H2O2溶液 | —————— | 开始无明显现象,10小时后,溶液变为浅蓝色,铜表面附着一层蓝色固体 |
Ⅱ | 将铜片置于硫酸酸化的H2O2溶液中 | 再通过C加入8mL 5mol/L 的稀硫酸 | 开始铜片表面产生少量气泡,随着反应的进行,气泡越来越多,溶液颜色为蓝色,铜片表面保持光亮 | |
Ⅲ | 将铜片置于有氨水的H2O2溶液中 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,溶液颜色变为深蓝色,铜片表面有一层蓝色固体附着,产生的气体能使带火星的木条复燃 | |
Ⅳ | 将铜片置于加有氨水和NH4Cl的H2O2溶液中 | 先向A中加入0.5g光亮的铜片和0.2g NH4Cl固体,再通过B加入30%的H2O2溶液 | 再快速通过C加入8mL 5mol/L的氨水 | 立即产生大量的气泡,______,铜片表面依然保持光亮 |
①仪器A的名称为______________________。
②实验Ⅰ中反应的化学方程式为___________________________。
③实验Ⅱ中产生的气体是________(写化学式),实验Ⅱ比实验Ⅰ/span>现象明显的原因是__________。
④实验Ⅲ中“溶液颜色变为深蓝色”所发生反应的离子方程式为________________。
⑤实验Ⅳ中空格处实验现象为__________,加入NH4Cl的作用是______________。
【答案】增大接触面积,使反应更充分 过滤 三颈烧瓶 Cu+ H2O2=Cu(OH)2 O2 酸性条件下提高了H2O2的氧化性 Cu+H2O2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 溶液颜色变为深蓝色 防止溶液中c(OH-)过高,生成Cu(OH)2沉淀
【解析】
本实验目的是探究“溶浸”过程中反应的实质,根据工业流程可知,铜在H2O2、NH3·H2O、NH4Cl溶液的共同作用下可以生成[Cu(NH3)4]Cl2,根据元素的化合价变化可知该过程中Cu被双氧水氧化;对比实验I和Ⅱ可知,在酸性环境下铜表面没有蓝色固体,可推测该蓝色固体应为Cu(OH)2;同时酸性环境下,Cu与双氧水的反应速率更快;根据活泼性关系可知该过程不可能产生氢气,所以产生的气体是双氧水分解生成的氧气,气泡之所以越来越多,是生成的Cu2+起到了催化作用。
(1)“粉碎”可以增大接触面积,使反应更加充分;废电路板中加入双氧水、氨气、氯化铵溶液,得到铜氨溶液和残渣,分离难溶性固体和溶液采用过滤方法,所以“操作”是过滤;
(2)①根据仪器A的结构特点可知其名称是三颈烧瓶;
②根据实验I的现象可知铜片被缓慢氧化,且生成Cu(OH)2,方程式为:Cu+ H2O2= Cu(OH)2;
③根据分析可知实验Ⅱ中产生的气体是O2;酸性条件下提高了H2O2的氧化性,所以实验Ⅱ比实验Ⅰ现象明显;
④含铜离子的溶液呈蓝色,该实验中溶液颜色变为深蓝色,结合题目所给的工艺流程可知,加入氨水后溶液中生成[Cu(NH3)4]2+,根据元素守恒和电荷守恒可得离子方程式为:Cu+H2O2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;
⑤根据实验Ⅲ的现象可知实验Ⅳ中溶液颜色也应变为深蓝色;根据实验Ⅰ和实验Ⅱ的对比可知酸性环境下没有蓝色固体生成,氯化铵水解使溶液显酸性,所以其作用是防止溶液中c(OH-)过高,生成Cu(OH)2沉淀。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子式为C4H8O3的有机物,在浓硫酸加热的条件下,具有如下性质:①能分别与CH3CH2OH或CH3COOH反应生成酯;②能脱水生成一种使溴水褪色的物质,且该物质的存在形式不只一种。则关于该物质的说法正确的是
A. 该物质不溶于水B. 该物质能发生缩聚反应,生成![]()
C. 该物质能生成四元环状化合物D. 两分子该物质能形成六元环酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是__(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)海水淡化的方法主要有___法、电渗析法、___法。
(3)如图是从海水中提取镁的简单流程。
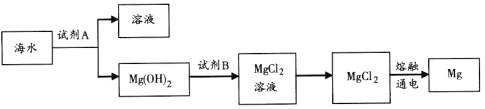
工业上常用于沉淀Mg2+的试剂A的俗名是__,无水MgCl2在熔融状态下通电制备金属Mg的化学方程式是___。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
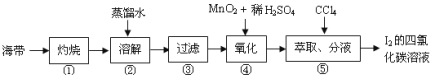
①灼烧海带至灰烬时所用的主要仪器名称是___。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式__。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈__色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将FeCl3溶液和KI溶液混合,发生反应:2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是
2Fe2+(aq)+I2(aq)。下列各项能判断上述可逆反应达到平衡状态的是
A. 溶液颜色不再变化
B. c(K+)不再变化
C. c(Fe3+)与c(Fe2+)之和不再变化
D. v正(I-)=2v正(I2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )

A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是

A. A装置中通入的a气体是Cl2
B. 实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C. B装置中通入b气体后发生的反应为SO2+Br2+2H2O===H2SO4+2HBr
D. C装置的作用只是吸收多余的SO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )
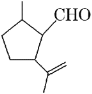
A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:
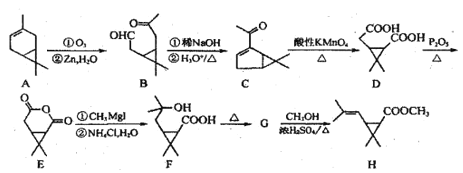
已知:R1CHO+R2CH2CHO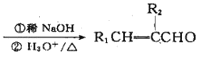
(1)写出一分子的 F 通过酯化反应生成环酯的结构简式__________。
(2)写出 G 到 H 反应的化学方程式___________。
(3)写出满足下列条件的 C 的一种同分异构体的结构简式______________。
①能与FeCl3 溶液发生显色反应;②分子中有 4 种不同化学环境的氢。
(4)写出以![]() 和 CH3CH2OH为原料制备
和 CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com