
【题目】铝元素之间的相互转化如图所示,下列叙述正确的是( )

A.实现①的转化,可通入过量CO2
B.实现②的转化,可加入过量NaOH溶液
C.实现③的转化,可加入过量NaOH溶液
D.实现④的转化,可通入过量NH3
科目:高中化学 来源: 题型:
【题目】下表为某有机物与各种试剂的反应现象,则这种有机物可能是( )
试剂 | 钠 | 溴水 |
|
现象 | 放出气体 | 褪色 | 放出气体 |
A.CH2=CH-CH2-OHB.![]()
C.CH2=CH-COOHD.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。

(1)表示NO2浓度变化的曲线是_____,写出相应的化学方程式:____________________。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_____,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体,某新型催化剂能促使NO、CO转化为2种无毒气体。T℃时,将0.8 mol NO和0.8 mol CO充入容积为2 L的密闭容器中,模拟尾气转化,容器中NO物质的量随时间变化如图。
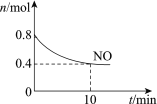
(1)将NO、CO转化为2种无毒气体的化学方程式是______。
(2)反应开始至10 min,v(NO)=______mol/(Lmin)。
(3)下列说法正确的是______。
a.新型催化剂可以加快NO、CO的转化
b.该反应进行到10 min时达到化学平衡状态
c.平衡时CO的浓度是0.4 mol/ L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用二氧化锰和浓盐酸共热制取氯气。为了证明得到的氯气中含氯化氢,并测定氯化氢的含量进行了下列实验。请回答:
(1)向饱和NaCl溶液中滴入少量浓盐酸,会有白色晶体析出,该晶体的化学式是_____。
(2)按如图装置,将所得气体通入后,试管内白色晶体析出,能否证明氯气中含有HCl,说明理由_____。b装置的作用是_____。

(3)已知氯气易溶于CCl4,按图中装置实验试管③中有白色沉淀,能够证明含HCl,说明理由_____。用浓盐酸与二氧化锰加热经干燥得到1.12L(标况下)气体,除去Cl2后,用水全部吸收并定容至100mL,再通过滴定测HCl气体含量。

(4)定容所需要仪器有烧杯、玻璃棒、________和_____。
(5)取定容后溶液20.00mL,加入2滴酚酞试液,用0.0250mol/L标准NaOH溶液滴定,当______即为滴定终点,消耗NaOH溶液19.20mL,则得到的气体中氯化氢的体积含量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池,电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1mol CH4,可以向外电路提供约![]()
![]() 的电量;
的电量;
②负极上CH4失去电子,电极反应式为: CH4-8e-+10OH—=CO32-+7H2O
③负极上是O2获得电子,电极反应式为![]() ;
;
④电池放电后,溶液pH不断升高
A.①②B.①③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L 浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
D.常温常压下,92 g的NO2和N2O4混合气体中含有的氮原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com