
| A. | 9种、7种、6种 | B. | 9种、5种、6种 | C. | 7种、5种、4种 | D. | 8种、5种、5种 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等;
强电解质:在水溶液中能完全电离的电解质;
弱电解质:在水溶液中部分电离的电解质;
单质与混合物既不是电解质也不是非电解质.
解答 解:钠是单质既不是电解质也不是非电解质;
Br2是单质既不是电解质也不是非电解质;
CO2 SO3属于非金属氧化物,本身不能电离产生自由移动离子,属于非电解质;
NH3本身不能电离产生自由移动离子,属于非电解质;
H2S水溶液中部分电离出自由移动离子而导电,属于电解质中的弱电解质;
硫酸水溶液中完全电离出自由移动离子而导电,属于电解质中的强电解质;
醋酸水溶液中部分电离出自由移动离子而导电,属于电解质中的弱电解质;
Ba(OH)2水溶液中完全电离出自由移动离子而导电,属于电解质中的强电解质;
NH3•H2O水溶液中部分电离出自由移动离子而导电,属于电解质中的弱电解质;
氯化钠水溶液中完全电离出自由移动离子而导电,属于电解质中的强电解质;
硫酸钡熔融状态完全电离出自由移动离子而导电,属于电解质中的强电解质;
乙醇不能电离出自由移动的离子,属于非电解质;
盐酸是混合物,既不是电解质也不是非电解质;
蔗糖不能电离出自由移动的离子,属于非电解质;
胆矾水溶液中完全电离出自由移动离子而导电,属于电解质中的强电解质;
所以:属于电解质有8种、非电解质有5种、强电解质5种;
故选D.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,明确相关概念是解题关键,注意单质与混合物既不是电解质也不是非电解质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
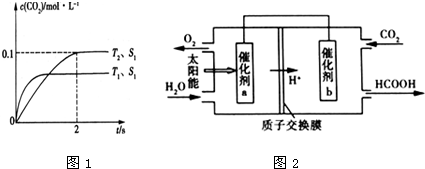
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属发生腐蚀的实质是:M-ne-=Mn+ | |
| B. | 金属发生的电化学腐蚀比化学腐蚀要普遍得多 | |
| C. | 防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜 | |
| D. | 在钢铁上连接一个铜块可以防止钢铁生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
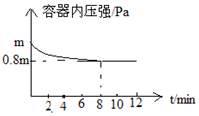 为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示:
为氮及其化合物在工农业生产、生活中有着重要作用.在T℃时,将0.6mol H2和0.4mol N2置于容积2L的密闭容器中(压强为mPa)发生反应:N2(g)+3H2(g)?2NH3(g)△H<0 若保持温度不变,测得反应过程中容器内压强随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NOx被还原 | B. | CO是还原剂 | ||
| C. | NOx反应中得到电子 | D. | CO发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com