
����Ŀ��ij��ɫũҩ�ṹ��ʽΪ���ش��������⡣

(1)NԪ�صĻ�̬ԭ�Ӻ�����_____�ֿռ��˶�״̬�ĵ��ӣ���ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����(���ɴ�С˳������)__________________����Ԫ�ط��Żش���ͬ������̬��ԭ�ӵļ۲�����Ų�ʽΪ________________________��
(2)���������ӻ��������Ϊsp2��ԭ����__________��
(3)̼���⡢��Ԫ�ؿ��γ�һϵ�еĻ������CH4��C2H6��CH3OH�ȡ���CH4��Ϊ�ȵ������һ������______��
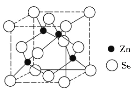
(4)����п�ľ����ṹ��ͼ��ʾ����������λ��Ϊ_______���������߳�Ϊd pm���谢���ӵ�������ֵΪNA��������п���ܶ�Ϊ____________g/cm3��
���𰸡� 7 F��N��O 4s24p4 N��C NH4+ 4 ![]()
����������1�����ݵ�ԭ�Ӻ�����7�������жϣ�һ��ǽ�����Խǿ����һ������Խ������ԭ�ӵļ۵�����Ϊ6��������
��2���ӻ�����ڿռ�ķֲ���ƽ�������Σ�����ӵ�����ԭ�ӷ���sp2�ӻ���
��3��ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壻
��4����������п�ľ����ṹ��Ͼ�̯�����㡣
��1����ԭ�Ӻ�����7�����ӣ����NԪ�صĻ�̬ԭ�Ӻ�����7�ֿռ��˶�״̬�ĵ��ӣ�һ��ǽ�����Խǿ����һ������Խ��Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ�����ũҩ���Ԫ���У���һ�����ܽϴ��ǰ����Ԫ����(���ɴ�С˳������)F��N��O����ԭ�ӵļ۵�����Ϊ6�������ڵ������ڣ����̬��ԭ�ӵļ۲�����Ų�ʽΪ4s24p4��
��2��������ƽ���νṹ��̼ԭ����sp2�ӻ���������Щ��ԭ���γ�1��˫����1�����������ӻ��������ҲΪsp2��
��3��CH4�����к���5��ԭ�ӡ�����8���۵��ӣ�����CH4��Ϊ�ȵ������һ������NH4+��
��4����������п�ľ����ṹ��֪Znԭ�ӵ���λ����4�����ݻ�ѧʽZnSe��֪������λ��ҲΪ4�������к���4��Znԭ�ӣ���Seԭ�Ӹ���Ҳ��4�����������߳�Ϊd pm�������������(d��10��10)3cm3���谢���ӵ�������ֵΪNA��������п���ܶ�Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��13C��NMR(NMR��ʾ�˴Ź���)�����ڲⶨ�����ʡ�������������ӵĿռ�ṹ�������й�13C�������У���ȷ����( )
A.13C��C60��ΪC�ĺ���B.13C��15N����ͬ��������
C.12C��13C��Ϊͬλ��D.13C������������ں���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã����ô�װ�úͱ����ṩ��������������ʵ�����
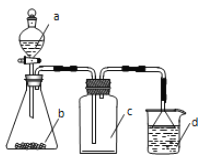
ѡ�� | a������ | b������ | c�е����� | d������ |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Cu | NO | H2O |
C | ���� | Na2CO3 | CO2 | NaOH��Һ |
D | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2CO3��NaHCO3�����Һ����μ���ϡ���ᣬ�����������������������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ������������ ��

A��a���Ӧ����Һ�У�Na����OH����SO42-��NO3-
B��b���Ӧ����Һ�У�K����Ca2����MnO4-��Cl��
C��c���Ӧ����Һ�У�Na����Ca2����NO3-��Cl��
D��d���Ӧ����Һ�У�F����NO3-��Fe2����Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��ͬѧ��ʵ������±���Ʊ�����Mg(ClO3)2��6H2O����������ͼ��ʾ��
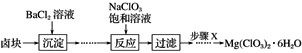
��֪����±����Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4��FeCl2�����ʡ�
�����ֻ�������ܽ��(S)���¶�(T)�ı仯������ͼ��ʾ��
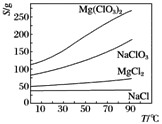
���γ������������ʱ����ͬ���Ӷ�Ӧ��Һ��pH���£�Fe2����ʼ������pHΪ5.8����ȫ������pHΪ8.8��Fe3����ʼ������pHΪ1.1����ȫ������pHΪ3.2��Mg2����ʼ������pHΪ8.2����ȫ������pHΪ11��
�ܿ�ѡ�õ��Լ���H2O2��ϡ���ᡢKMnO4��Һ��MgCl2��Һ��MgO��
(1)����X�����IJ���Ϊ___________�� ___________��____________������ϴ�Ӳ����
(2)����BaCl2��Һ�������辭������ʵ�鲽��Ž����²���Ӧ����д��������ʵ�鲽�裺
��________________________________________________________________________��
�� _______________________________________________________________________��
(3)����NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ_______________________________��
(4)��Mg(ClO3)2���뵽����KSCN��FeSO4��Һ���������ֺ�ɫ��д����ط�Ӧ�����ӷ���ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Խ����У���MnSO4��Һ�еμ�(NH4)2S2O8(��������泥���Һ�ᷢ�����·�Ӧ��2Mn2+ + 5S2O82- + 8H20��2MnO4- + 10SO42- + 16H+��
(1)�õ����ű�ʾ��������ʽ����ת�Ʒ������Ŀ��____________ ��
(2)�÷�Ӧ�л�ԭ��Ϊ��____________________________��
(3)�÷�Ӧ�����ڼ���Mn2+�Ĵ��ڣ��������ǣ�________________________________��
(4)����Ӧ����0.1mol�Ļ�ԭ���μӷ�Ӧ����ת�Ƶĵ�����ĿΪ__________NA�����������������ʵ���Ϊ____________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH3BO3������Ӧ���ڲ���������ҵ������þ��2MgOB2O3H2O��SiO2������Fe3O4��CaCO3��Al2O3��Ϊԭ����������Ĺ���������ͼ��

��֪��i��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��5.2��9.7��12.4��
����H3BO3��20�桢40�桢60�桢100��ʱ���ܽ������Ϊ5.0g��8.7g��14.8g��40.2g��
��1��Ϊ�������þ��۵Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ��___________�����ٴ���������
��2��������Һ�������ԣ���H3BO3��Mg2+��SO42����������Fe3+��Fe2+��Ca2+��Al3+�����ʣ������ӡ�ʱ�����Һ�����μ�������H2O2��MgO��H2O2��������_______________________ �������ӷ���ʽ��ʾ����MgO��ȥ������������____________________��
��3����֪H3BO3�������NaOH��Ӧ����Na[B��OH��4]����д��H3BO3����Һ�еĵ��뷽��ʽ_______________________��
��4������ȡ�����á��ȹ��ˡ���Ŀ����______________��ĸҺ�е���Ҫ������___________��___________����Ҫ�����֣���
��5���ⶨ���ò�Ʒ�Ĵ��ȣ�ȡa g���ᣬС�ļ���ʹ��ֽ���ȥˮ�֣��������Ȳ��ֽ⣩���ò�������b g�����Ʒ�Ĵ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ����ͼ�����л��ɷ����ķ�Ӧ������
��ȡ�� �ڼӳ� ����ȥ ������ ��ˮ�� ������ ���к� ������ ��Ӿ�
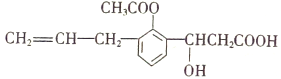
A. �٢ڢۢݢޢ� B. �ڢۢܢݢޢ�
C. �٢ڢۢܢݢޢߢ�� D. �ڢۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaAlO2��Ba(OH)2��NaOH���100.0 mL�����Һ�������Һ��ͨ������CO2�����ɳ��������ʵ���n(����)����ͨ��CO2�����ʵ���n(CO2)�Ĺ�ϵ����ͼ��ʾ������˵������ȷ����
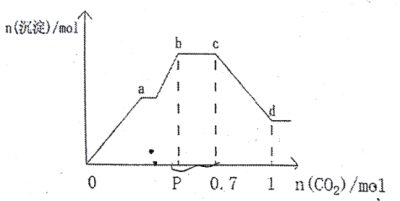
A. P���ֵΪ0.6
B. �����Һ��c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc�εĻ�ѧ��Ӧ����ʽΪ��NaOH+CO2=NaHCO3
D. cd�α�ʾAl(OH)3�����ܽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com