
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).
; X、Y、Z三种元素的原子半径从大到小的顺序是Mg>N>O (用元素符号表示).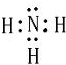 ;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).
;化合物ZY中存在的化学键类型为离子键 (填“离子键”或“共价键”).分析 X是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则X为N元素;Y是地壳中含量最高的元素,则Y是O元素;Z存在质量数为23,中子数为11的核素,Z的质子数是23-11=12,则Z为Mg元素;生活中大量使用W合金制品,工业上可用电解熔融氧化物的方法制备其单质,则W是Al元素;R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
解答 解:X是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则X为N元素;Y是地壳中含量最高的元素,则Y是O元素;Z存在质量数为23,中子数为11的核素,Z的质子数是23-11=12,则Z为Mg元素;生活中大量使用W合金制品,工业上可用电解熔融氧化物的方法制备其单质,则W是Al元素;R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
(1)W为Al,原子结构示意图为 ,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>N>O,
,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>N>O,
故答案为: ;Mg>N>O;
;Mg>N>O;
(2)N与氢两元素按原子数目比1:3的化合物是NH3,电子式为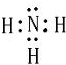 ,化合物ZY为MgO,存在的化学键为离子键,
,化合物ZY为MgO,存在的化学键为离子键,
故答案为: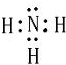 ;离子键;
;离子键;
(3)砷(As)是人体必需的微量元素,与N元素同一主族,As原子比N原子多两个电子层,同主族自上而下非金属性减弱,氢化物稳定性减弱,故气态氢化物的稳定性:AsH3>NH3,
故答案为:弱;
(4)检验溶液中Fe3+常用的试剂是KSCN溶液,可以观察到的现象是 溶液呈红色,
故答案为:KSCN溶液;溶液呈红色.
点评 本题考查较为综合,涉及结构性质与位置关系、常用化学用语、元素周期律、离子检验等,推断元素是解题关键,有利于基础知识的巩固,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$ Ne互为同位素 | B. | $\stackrel{20}{10}$Ne和$\stackrel{22}{10}$Ne互为同素异形体 | ||
| C. | 具有相同的中子数 | D. | $\stackrel{20}{10}$Ne与羟基(-OH)所含电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
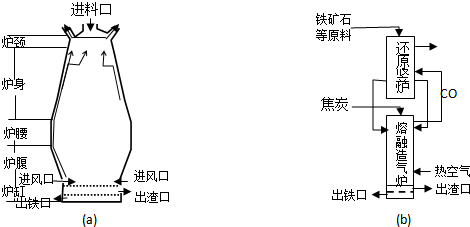
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
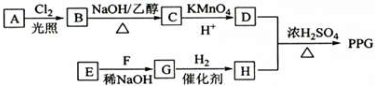
 .
. .
. .
. .
. :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
| A. | C9H18 | B. | C9H118O2 | C. | C8H18 | D. | C8H16O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com