
��֪25��ʱ�й�����ĵ���ƽ�ⳣ����
| ���� | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.8��l0-5 | 4.9��l0-10 | K1=4.3��l0-7 K2=5.6��l0-11 |
D
�������������A�����ݵ���ƽ�ⳣ����֪��HCN���������ڴ���ģ����HCN�����ᣬ��Ũ��Ϊ0.1mol/L��HCN��Һ��c(OH��)��10��13mol/L��A����ȷ��B��ˮ�����ӻ�����ֻ���¶��й�ϵ�����������ʵ���Ũ����ͬ��ϡ����Һ��KW��CH3COOH��H2CO3��HCN��B����ȷ��C�����ݵ���ƽ�ⳣ����֪������ǿ��˳����CH3COOH��H2CO3��HCN��������Խ������Ӧ������Խ����ˮ�⣬��Һ�ļ���Խǿ���������ʵ���Ũ����ͬ������������Һ��pH��NaCN��NaHCO3��CH3COONa��C����ȷ��D��Ũ�Ⱦ�Ϊamol?L-1HCN��Һ��NaOH��Һ�������ϣ�����ǡ�÷�Ӧ����NaCN��CN��ˮ����Һ�Լ��ԣ���c(H+)��c(OH-)��c(CN-)��0.5amol/L��D��ȷ����ѡD��
���㣺�������ƽ�⡢ˮ��ƽ���Ӧ���Լ���Һ������Ũ�ȴ�С�Ƚ�


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����ʵ���Ũ�ȵ�������Һ�У�c( )�����ǣ� ��
)�����ǣ� ��
| A��NH4HCO3 | B��NH4NO3 | C��(NH4)2CO3 | D��NH4HSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Ũ�Ⱦ�Ϊ0.10mol��L��1�Ĵ���V1 mL������������ҺV2 mL������˵����ȷ����
| A�������£�������Һ�У�������Һ��pH=1������������Һ��pH=13 |
| B�������£�������Һ��Ϻ�pH=7������Һ��c(Na��)��c(CH3COO��) |
| C���� V1= V2��������Һ��ϣ����û��Һ��c(CH3COO��)��c(Na��)��c(H��)��c(OH��) |
| D��V1��V2����Ȼ�ϣ����û��Һ��c (Na��)+ c(H+) ��c(OH��)+ c (CH3COO��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
A��������pH=12��NaOH��Һ��������0.01mol��Lһl�Ȼ����Һ��Ϻ�������Һ�У�c(Na+)=c(NH )
)
B��������ˮ�У�c(Cl-)��c(H+)��c(OH-����c(ClO-��
C�������£���0.0lmol/L NH4HSO4��Һ�еμ�NaOH��Һ�����ԣ�c(Na+)��c(SO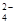 ����c(NH
����c(NH )��c(OH-��=c(H+)
)��c(OH-��=c(H+)
D�����ʵ���Ũ�Ⱦ�Ϊ0.lmol/L��NaA��NaB������Һ�У�����Ũ�ȵĹ�ϵһ��Ϊ��c(Na+)��c(OH-����c(HA)��c(HB)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ж���25��ʱpHΪ12�İ�ˮ��������ȷ����
| A����ˮ�����c��OH����=1.0��10-2mol��L-1 |
B�� |
C����������pH=2�������Ϻ����õ���Һ�У� |
D������һ����pH=2�Ĵ�����Һ��Ϻ����õ���Һ�У�  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����ݾ�Ϊ100mL0.5mol��L-1NaHCO3��Һ�У��ֱ�������������ᡢCa(OH)2���塢NaAlO2���壨������Һ����仯������������Һ��c(CO32��)�ı仯����Ϊ
| A�������������� | B�������������� |
| C������С����С | D����С������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ij��Һ��ֻ����Na+��H+��OH����A���������ӣ�����˵����ȷ����
A��������ΪNaA��HA����һ������c(A��)��c(Na+)��c(H+)��c(OH��)
B����c(OH��)��c(H+)����Һ�в����ܴ���c(Na+)��c(OH��)��c(A��)��c(H+)
C����Һ�п��ܴ���c(Na+)��c(A��)��c(H+)��c(OH��)
D��������ΪNaA����Һ�п��ܴ��ڣ�c (OH��)��c(H+)+c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��H2SO3��Ka1��1.3��10��2��Ka2��6.3��10��8��H2CO3��Ka1��4.2��10��7��Ka2��5.6��10��11���ֽ���״����2.24L��CO2��2.24L��SO2�ֱ�ͨ������150mL1mol/LNaOH��Һ�У���������Һ�ıȽ�����˵����ȷ����
| A��c(HCO3��)��c(CO32��) |
| B������Һ����ʹ���Ը��������Һ��ɫ |
| C��c(HCO3��)��c(HSO3��) |
| D��c(CO32��)+ c(HCO3��)=c(SO32��)+ c(HSO3��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£������Ϊ10 mL�����ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L������ʹ���Ļ����Һ�е���0.1 mol��L NaOH��Һ������˵���������( )
| A������NaOH��Һ����Һһ�����㣺 c(H+)+c(Na+)=c(OH-)+c(C1-)+c(CH3COO-) |
| B������10 mLNaOH��Һʱ����Һ����(��Һ����仯���Բ���)�� c(CH3COO-)+c(CH3COOH)="0.05" mol/L |
| C������15 mLNaOH��Һʱ�������ԣ���Һ���㣺 c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D����������NaOH��Һʱ����Һ�з������кͷ�Ӧ���Ȼ�ѧ����ʽ��ʾΪ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com