
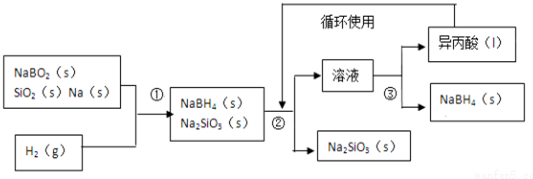
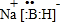 ;其中B元素的化合价为+3
;其中B元素的化合价为+3分析 NaBO2、SiO2、Na和H2在一定条件下反应生成NaBH4、Na2SiO3,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出;NaBH4可溶于异丙胺,根据③知,②中加入的溶剂是异丙胺,NaBH4溶解于异丙胺、Na2SiO3不溶于异丙胺,难溶性固体和溶液采用过滤方法分离,通过过量得到滤液和滤渣,滤渣成分是Na2SiO3;异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4;
(1)NaBH4中Na为+1价,B为+3价,可结合化合物中各元素正负化合价代数和为0,计算出氢元素的化合价,①反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平方程式;
(2)原料中的金属钠通常保存在煤油中,需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,为防止安全事故发生和防止NaBH4水解,在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,从而排出空气和水蒸气;
(3)根据转移电子守恒、原子守恒配平方程式;
(4)分离难溶性固体和溶液采用过滤;熔沸点相差较大的可以采用蒸馏方法.
解答 解:(1)NaBH4中根据化合物中各元素正负化合价代数和为0,并结合Na为+1价、B为+3价计算出H为-1价,第①步反应中根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,电子转移数目为4e-,
故答案为: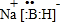 ;+3;
;+3;
(2)钠的密度大于煤油,为隔绝空气和水,原料中的金属钠通常保存在煤油中,实验室取用少量金属钠时,需要镊子夹取钠、用滤纸吸煤油,所以实验室取用少量金属钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀等,NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出,钠极易和空气中氧气、和水反应,
故答案为:除去装置中的空气和水蒸气;
(3)第①步反应中根据转移电子守恒、原子守恒配平方程式为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,
故答案为:1,2,4,2-1,2;
(4)分离难溶性固体和溶液采用过滤方法,需要的玻璃仪器有烧杯、玻璃棒、漏斗;②中加入的溶剂是异丙胺,NaBH4溶解与异丙胺、Na2SiO3不溶于异丙胺,所以第②步分离采用的方法是过滤;熔沸点相差较大的可以采用蒸馏方法,异丙胺沸点:33℃,将滤液采用蒸馏的方法分离,得到异丙胺和固体NaBH4,
故答案为:烧杯、玻璃棒、漏斗;蒸馏.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生分析推断及知识综合应用能力,涉及物质分离提纯、热化学反应方程式的书写、氧化还原反应、实验基本操作等知识点,综合性较强且较基础,难点是分析流程图中发生的反应、基本操作等,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据题目要求,回答下列问题:
根据题目要求,回答下列问题: CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.
CH3COOC2H5+H2O.装置中干燥管的作用是防止倒吸,小试管中的试剂为饱和碳酸钠溶液.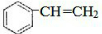 .在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为
.在一定条件下,A发生聚合反应得到一种高分子化合物,该反应的化学方程式为 .A与氢气完全加成后产物的一氯代物共有5种.
.A与氢气完全加成后产物的一氯代物共有5种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
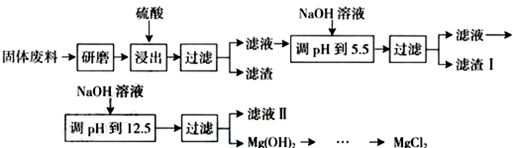
| 沉淀物 | Fe3+ | Al3+ | Mg2+ |
| pH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com