
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
分析 (1)已知:①Fe2O3(s)+3C(石墨,s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨,s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),则△H=△H1-3△H2;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由(1)中可知正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)①令平衡时参加反应的CO为xmol,表示出平衡时各组分的物质的量,根据平衡常数列方程计算x,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
②a.反应前后气体质量变化,体积不变,随反应进行气体密度发生变化,若容器内气体密度恒定时,标志反应达到平衡状态;
b.甲、乙为等效平衡,平衡时CO的含量相等,结合①中计算数据可知乙中平衡时CO的物质的量,进而计算转化率判断;
c.甲、乙为等效平衡,平衡时CO的含量相等,CO的含量=$\frac{CO平衡浓度}{混合气体总浓度}$;
d.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
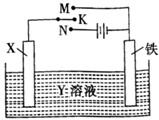
(4)①若X为碳棒,为减缓铁的腐蚀,应外界电流的阴极保护,使Fe连接电源的负极;
②若X为锌,开关K置于M处,构成原电池,Zn为负极被腐蚀,Fe为正极,正极上是氧气获得电子生成氢氧根离子;
(5)A.放电时,Zn被氧化生成Zn(OH)2;
B.充电过程为电解池,Fe(OH)3失去电子生成K2FeO4;
C.放电时,Fe化合价由+6价降低为+3价,则K2FeO4被还原;
D.放电时正极附近产生氢氧根离子.
解答 解:(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律,①-②×3得Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),故△H=489.0kJmol-1-3×172.5kJmol-1=-28.5kJmol-1,
故答案为:-28.5;
(2)Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)的平衡常数K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,该反应是放热反应,升温平衡逆向进行,平衡常数减小;
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;减小;
(3)①在T℃时,该反应的平衡常数K=64,甲容器内浓度商Qc=1,小于平衡常数,反应向正反应进行,设消耗一氧化碳物质的量为x,则:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol):1 1
变化量(mol):x x
平衡量(mol):1-x 1+x
反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,故 $\frac{(1+x)^{3}}{(1-x)^{3}}$=64,解得x=0.6,
故CO的转化率=$\frac{0.6mol}{1mol}$×100%=60%,
故答案为:60%;
②a.反应前后气体质量变化,体积不变,随反应进行气体密度发生变化,若容器内气体密度恒定时,标志反应达到平衡状态,故a正确;
b.甲、乙为等效平衡,平衡时CO的含量相等,结合①中计算数据可知乙中平衡时CO的物质的量3mol×$\frac{0.4}{2}$=0.6mol,故乙中CO的转化率为$\frac{2mol-0.6mol}{2mol}$=70%,故甲中CO转化率小于乙中CO转化率,故b正确;
c.甲、乙为等效平衡,平衡时CO的含量相等,由于CO的含量=$\frac{CO平衡浓度}{混合气体总浓度}$,则平衡时甲、乙中CO的平衡浓度之比为2mo/L:3mol/L=2:3,故c错误;
d.Fe2O3为固体量,增加其用量,不影响化学平衡移动,不能提高CO的转化率,故d错误,
故选:ab;
(4)①若X为碳棒,为减缓铁的腐蚀,应外界电流的阴极保护,使Fe连接电源的负极,开关K应置 N处,
故答案为:N;
②若X为锌,开关K置于M处,构成原电池,Zn为负极被腐蚀,Fe为正极,正极上是氧气获得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(5)A.放电时,Zn被氧化生成Zn(OH)2,电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故A正确;
B.充电过程为电解池,Fe(OH)3失去电子生成K2FeO4,电极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B正确;
C.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D.放电时正极附近产生氢氧根离子,溶液的碱性增强,故D错误,
故选:AB.
点评 本题考查化学平衡计算、平衡常数、反应热计算、电化学等,(3)中②为易错点,容易根据等效平衡认为转化率相等,难度中等.


科目:高中化学 来源: 题型:解答题
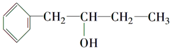 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA | |
| B. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| C. | 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA | |
| D. | 62gNa2O溶于水后所得溶液中含有O2-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 | |
| B. | 胶体粒子带电荷 | |
| C. | 分散质粒子直径在1 nm~100 nm之间 | |
| D. | 产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④ | C. | ③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
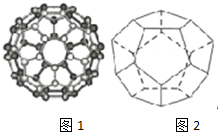 碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖
碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com