
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
(1)—1(共1分)
(2)H2O 3.01×1023或0.5NA(共3分;第一空1分,第二空2分)
(3)2NaH+TiCl4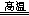 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4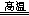 Ti+4NaCl+2H2↑(共2分)
Ti+4NaCl+2H2↑(共2分)
解析试题分析:(1)化合物中钠元素为+1价,由化合价代数和为0可知,氢元素为—1价;(2)氢元素既由—1价升为0价,又由+1价降为0价,既被氧化又被还原,则 NaH是还原剂,H2O是氧化剂;由m/M可知,n(NaH)=0.5mol;由化合价升降总数为1可知,NaH~e—,则该反应转移0.5mol电子,由n?NA可知,N(e—)=3.01×1023或0.5NA;(3)钛元素由+4价降低到0价,由此推测氢元素由—1价升高为0价或+1价,由化合价升价总数相等、原子守恒可知,2NaH+TiCl4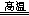 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4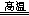 Ti+4NaCl+2H2↑。
Ti+4NaCl+2H2↑。
考点:考查元素化合价、氧化剂、物质的量、转移电子数、氧化还原反应方程式等相关知识。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| | X | Y | Z |
| W | | | |

 。
。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组用以下装置探究SO2的某些化学性质。
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式: Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3—对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3—还原为N2,其化学方程式为:10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O。
请回答下列问题:
①上述反应中_________元素的化合价升高,则该元素的原子____________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是_________________________________。
②漂白粉的有效成分是(填化学式)____________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: 
(1)该盐酸的物质的量浓度为 mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为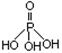 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
Fe3O4+6SO2,有3mol FeS2参加反应,转移 mol电子。
(2)FeCl3溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)与明矾相似,Fe2(SO4)3也可用作净水剂,在使用时发现Fe2(SO4)3并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)钢铁的电化学腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框中作出修改,并用箭头标出电子流动的方向。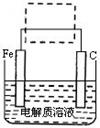
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请把符合要求的化学方程式的字母填在下列空白处:
①既属于分解反应又是氧化还原反应的是____________________________
②属于分解反应,但不是氧化还原反应的是__________________________
③属于化合反应,但不是氧化还原反应的是__________________________
④不属于四种基本反应类型的氧化还原反应的是______________________
A.(NH4)2SO3  2NH3↑+H2O+SO2↑ 2NH3↑+H2O+SO2↑ |
| B.2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O |
C.2C+SiO2  Si+2CO↑ Si+2CO↑ |
D.NH4NO3  N2O↑+2H2O N2O↑+2H2O |
 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com