
A.pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且 c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
科目:高中化学 来源: 题型:阅读理解
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
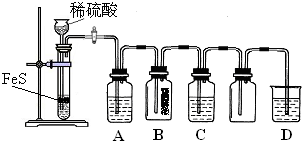
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
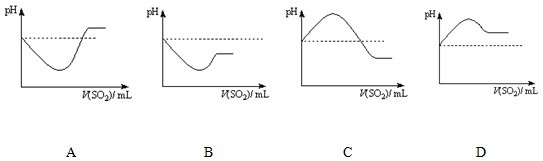
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 液氨 |
| C2H5OC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
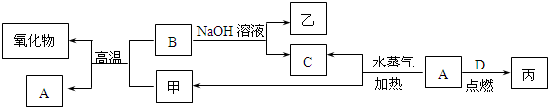
| ||
| ||
| ||
| ||
| n |
| 33.6 |
| n |
| 33.6 |
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中c(CO32-):c(HCO3-)<1:2 | B、溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 | D、将混合液蒸干,水解加剧,最终得NaOH固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com