
【题目】Fe是日常生活中最常用的金属之一。回答下列问题:
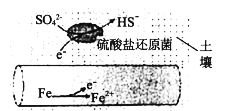
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被SO42-腐蚀,其电化学腐蚀原理如下图所示,写出正极的电极反应式___________________。
(2)在1800K时,2Fe(s)+3/2O2(g)=Fe2O3(s) H=-354.2kJ/mol;3Fe(s)+2O2(g)=Fe3O4(s) H=-550.9kJ/mol则反应:2Fe3O4(s)+1/2O2(g) ===3Fe2O3(s)的H为_____ kJ·mol1,四氧化三铁在充满氧气的集气瓶中反应生成Fe2O3_____(填“能”或“不能”)自发进行。
(3)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2+ +I2(在水溶液中)。
2Fe2+ +I2(在水溶液中)。
①298K时,向5mL 0.1molL1 的KI溶液中滴加0.1molL1 FeCl3溶液,得到c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:
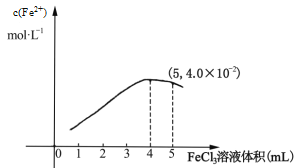
该温度下滴加5mL FeCl3溶液时,Fe3+的平衡转化率=_____%,平衡常数K=_____,若要提高Fe3+的转化率,可采取的措施是________________________。
②在已经达到平衡的上述反应体系中,加入苯对I2进行萃取,保持温度不变,反应速率_____ (填“增大”、“减小”或“不变”),此时υ(正)_____υ(逆)(填“大于”、“小于”或“等于”)。
③υ(正)与Fe3+、I的浓度关系为υ=kc(I-)mc(Fe3+)n(k为常数)
c(I)molL1 | c(Fe3+)molL1 | υ (molL1s1 ) | |
(1) | 0.20 | 0.80 | 0.032k |
(2) | 0.60 | 0.40 | 0.144k |
(3) | 0.80 | 0.20 | 0.128k |
通过分析所给数据计算可知:在υ=kc(I-)mc(Fe3+)n 中,m,n的值为_____(填字母代号)。
A.m=1,n=1 B.m=2,n=1 C.m=2,n=2 D.m=1,n=2
【答案】SO42-+5H2O+8e-=HS-+9OH- +39.2 不能 80 3200 增大I-的浓度 减小 大于 B
【解析】
(1)根据图示,正极得电子,发生还原反应,电极反应为:SO42-+5H2O+8e-=HS-+9OH-;
(2)根据盖斯定律,由已知两个热化学方程式得:2Fe3O4(s) +![]() O2(g)=3Fe2O3(s) 的H=-2
O2(g)=3Fe2O3(s) 的H=-2![]() H2+3
H2+3![]() H1=-2
H1=-2![]() (550.9 kJmol-1)+3
(550.9 kJmol-1)+3![]() (354.2 kJmol-1)=+39.2kJmol-1;反应为混乱度减小的反应,且反应是吸热,所以该反应不能自发进行;
(354.2 kJmol-1)=+39.2kJmol-1;反应为混乱度减小的反应,且反应是吸热,所以该反应不能自发进行;
(3) ①由图示可知,平衡时c(Fe2+)=4.0×10-2 molL 1,则Fe3+的平衡转化率(×mol/L×10mL)÷(mol/L×5mL)×100%=80%;平衡时2I-+ 2Fe3+![]() 2Fe2+ + I2平衡常数K=
2Fe2+ + I2平衡常数K=![]() =(4×10-2)2×(2×10-2)÷[(1×10-2)2×(1×10-2)2]=3200;若要提高 Fe3+的转化率, 可采取的措施是:增大I-的浓度;故答案为:80;3200;增大I-的浓度;
=(4×10-2)2×(2×10-2)÷[(1×10-2)2×(1×10-2)2]=3200;若要提高 Fe3+的转化率, 可采取的措施是:增大I-的浓度;故答案为:80;3200;增大I-的浓度;
②加入苯对 I2进行萃取使生成物浓度减小,反应速率减小,平衡向正反应方向移动,故正反应速率大于逆反应速率;故答案为:减小;大于;
③将表中的三组数据代入公式υ=kc(I-)mc(Fe3+)n,可得:
0.20m×0.80n=0.032k,0.60m×0.40n=0.144k,0.80m×0.20n=0.128k,
解得:m=2,n=1,
故答案为:B。


科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
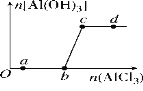
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将物质X分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈形如图所示状态。

①若如图一所示。该反应是______(填“放热”或“吸热”)反应,X是______(填两种化学式)。
②若如图二所示。该反应是______(填“放热”或“吸热”),以下选项中与其能量变化相同的有______。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应
(2)如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块铝片,再滴入5 mL稀NaOH溶液。
试回答下列问题:
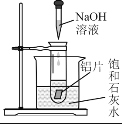
①实验中观察到的现象是:铝片逐渐溶解、铝片上有大量气泡产生、______。
②产生上述现象的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)H2(g) +1/2O2(g)=H2O(g) △H=-241.8 kJ/mol
(2)1/2N2 (g) + O2(g)=NO2(g) △H=+33.9 kJ/mol
(3)1/2N2 (g) +3/2 H2(g)=NH3(g) △H=-46.0 kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热
A.282.8 kJ/mol B.-282.8 kJ/mol C.848.4kJ/mol D.-848.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
D. CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。根据要求回答下列问题。
(1)下列说法中错误的是______。

A.都是清洁能源
B.电能,H2属于二次能源,水力是一级能源
C.煤和石油属于化石燃料,燃烧会产生温室气体
D.氢能热值高,对环境无污染
(2)我国目前使用的主要能源是化石燃料,近年来我国能源总消费量与人均能源消费量如图。
①在我国,煤的消费量巨大,且煤属于不可再生能源,寻找新能源是能源研究的主要课题之一。下列不属于新能源的是______。
A.太阳能 B.氢能 C.地热能 D.海洋能
E.生物质能 F.石油 G.天然气
②已知,1 kg煤大约放热2.9×104 kJ。风能能量巨大,地球上一年可利用的风能相当于5×1014 kw·h的电能。试计算,一年的风能若能全部利用,可相当于节省______吨燃煤。(已知,1 kw·h=3.6×103 kJ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________,占据最高能级的电子的电子云轮廓图形状为___________,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________。
(3)AlF3具有较高的熔点(1040℃),属于___________晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________,该阴离子中存在的化学键有___________(填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位健 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________。立方体边长为acm,阿伏加德罗常数的值为NA,则CaF2晶体的密度为___________g·cm-3(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去Na2CO3固体中混有的少量NaHCO3,可采取的方法是( )
A. 加热 B. 通入过量的CO2 C. 加入过量的石灰水 D. 加入稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同时对农作物施用含N、P、K的三种化肥,给定下列化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤NH3·H2O。其中最合理的组合方式是( )
A. ①③④ B. ②③④ C. ①③⑤ D. ②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com