
分析 (1)某烷烃中的碳氢质量比为5:1,则其分子中含有C、H原子数之比为:$\frac{5}{12}$:$\frac{1}{1}$=5:12,最简式为C5H12,该最简式中H已经达到饱和,则该烷烃的分子式即为其最简式;根据分子式确定其相对分子质量;
(2)戊烷在空气中燃烧生成二氧化碳气体和水,据此写出反应的化学方程式;
(3)该烷烃的一氯取代物只有1种,数目该烷烃分子中所有H原子都等效,为新戊烷.
解答 解:(1)某烷烃中的碳氢质量比为5:1,则其分子中含有C、H原子数之比为:$\frac{5}{12}$:$\frac{1}{1}$=5:12,最简式为C5H12,该最简式中H已经达到饱和,则该烷烃的分子式为:C5H12,其相对分子质量为:12×5+1×12=72,
答:该烷烃的分子式为C5H12,计算烷烃的相对分子质量为72;
(2)戊烷在空气中完全燃烧生成二氧化碳和水,反应的化学方程式为:C5H12+8O2$\stackrel{点燃}{→}$5CO2+6H2O,
答:戊烷在空气中燃烧的方程式为C5H12+8O2$\stackrel{点燃}{→}$5CO2+6H2O;
(3)分子式为C5H12的烷烃为戊烷,戊烷存在正戊烷、异戊烷和新戊烷三种同分异构体,该烷烃的一氯取代物只有1种,则戊烷分子中所有H原子都等效,该戊烷为新戊烷,其结构简式为: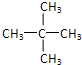 ,
,
答:该烷烃的结构简式为 .
.
点评 本题考查了有机物分子式、结构简式的确定、有机反应方程式书写,题目难度中等,注意掌握常见有机物结构与性质,明确同分异构的书写原则,能够正确书写常见有机反应方程式.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 水、双氧水、水玻璃都是纯净物 | B. | 乙醚和乙醇互为同分异构体 | ||
| C. | 乙醇、氯气、葡萄糖都是非电解质 | D. | 甲酸与硬脂酸属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解) | |
| B. | 1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子 | |
| C. | 在该溶液中,K+、NH4+、I-、SO42-可以大量共存 | |
| D. | 与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
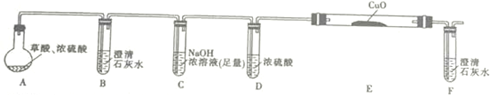
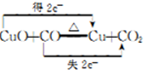 .
.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
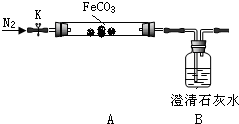
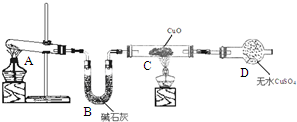 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com