
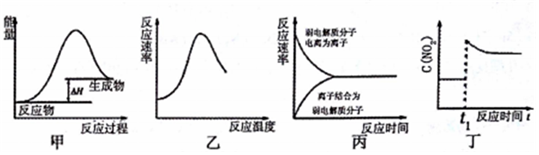
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(NO2)的变化 |
分析 A.燃料燃烧应放出热量,反应物总能量大于生成物总能量;
B.温度过高,酶失去催化活性;
C.弱电解质存在电离平衡,平衡时正逆反应速率相等;
D.此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移.
解答 解:A.燃料燃烧应放出热量,反应物总能量大于生成物总能量,而题目所给图为吸热反应,故A错误;
B.酶为蛋白质,温度过高,蛋白质变性,则酶催化能力降低,甚至失去催化活性,故B正确;
C.弱电解质存在电离平衡,平衡时正逆反应速率相等,图象符合电离特点,故C正确;
D.此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移,c(NO2)变小,与图象变小一致,故D正确,
故选A.
点评 本题考查较为综合,涉及弱电解质的电离、化学反应与能量、化学平衡的影响及移动,侧重学生的分析能力的考查,为高考常见题型,易错点为B,注意蛋白质的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向稀硝酸中加入FeO:FeO+2H+═Fe2++H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 | |
| B. | 工业上,电解熔融MgCl2制金属镁 | |
| C. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| D. | “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
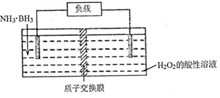 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )| A. | 负极附近溶液的PH增大 | |
| B. | 正极的反应式为:H2O2+2H++2e-=2H2O | |
| C. | 电池工作时,BO2-通过质子交换膜向正极移动 | |
| D. | 消耗3.lg氨硼烷,理论上转移0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
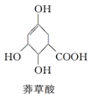
| A. | 分子中含有2种官能团 | |
| B. | 1mol莽草酸与Na反应最多生成4mol氢气 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为8的氮原子:${\;}_{8}^{15}$N | B. | 乙醇的实验式:C2H6O | ||
| C. | 氯化镁的电子式: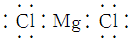 | D. | 硫原子的结构示意图: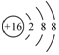 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com