
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol–1
2SO3(g) ΔH=196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol–1
2NO2(g) ΔH=113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。


A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
【答案】(1)① NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8kJ·mol–1(2分)②bd(2分)
SO3(g)+NO(g) ΔH=-41.8kJ·mol–1(2分)②bd(2分)
(2)① 0.1mol·L-1·min-1 (2分)②cd (2分)(3)①>(1分)②1(1分)<(1分)
(4)负(1分)O2 + 4e-+2CO2 = 2CO32-(2分)
【解析】
试题分析:(1)①根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g)![]() SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1。
SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.反应前后体积不变,所以压强不变,a错误; b.颜色深浅和浓度有关系,所以混合气体颜色保持不变说明反应达到平衡状态,b正确;c.SO3和NO的体积比始终保持1:1不变,不能说明反应达到平衡状态,c错误;d.每消耗1 mol SO2的同时生成1 molNO2,二者的反应速率的方向相反,且满足速率之比是相应的化学计量数之比,说明反应达到平衡状态,d正确,答案选bd。
(2)① 2min时测得生成CH3OH 0.2mol,则消耗氢气是0.4mol,所以0~2min的平均反应速率v(H2)=![]() 0.1mol·L-1·min-1 。
0.1mol·L-1·min-1 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,压强增大,平衡向正反应方向进行,a.c(H2)增大,a错误;b.正、逆反应速率均加快,b错误;c.CH3OH 的物质的量增加,c正确; d.重新平衡c(H2)/c(CH3OH)减小,d正确,答案选cd。
(3)①温度越高,反应速率越快,到达平衡的时间越少,则A、C两点到达平衡状态所需的时间tA>tC。
② CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初起浓度(mol/L) 1 2 0
变化浓度(mol/L) 0.5 1 0.5
平衡浓度(mol/L) 0.5 1 0.5
故K=![]() =1
=1
升高温度转化率降低,说明平衡向逆反应方向进行,所以平衡常数减小,即C点的平衡常数KC<KB。
(4)A电解通入燃料,所以A为电池的负极。正极是氧气得到电子,则B极电极反应式为O2 + 4e-+2CO2 = 2CO32-。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置分别盛放相应物质进行下列实验,得出结论正确的是
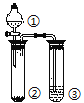
选项 | ① | ② | ③ | 判定结论 |
A | 浓硫酸 | 蔗糖 | 溴水 | 用来判定浓硫酸具有脱水性、氧化性 |
B | 稀盐酸 | Na2SO3 | Ba(NO3)2 | 用来判定SO2与可溶性钡盐均可生成白色沉淀 |
C | 浓盐酸 | Na2CO3 | Na2SiO3 | 用来判定酸性:盐酸>碳酸>硅酸 |
D | 浓硫酸 | Cu | NaOH | 用来判定制备SO2并吸收尾气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。

下表中对实验现象所做的解释不正确的是:
选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与HCl反应产生了NH4Cl固体 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3与水反应生成了NH3·H2O,电离出OH-使红色石蕊试纸变蓝 |
D | 硫酸铜溶液变浑浊 | 生成Cu(OH)2沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A. (![]() -
-![]() ) mol/L B. (2b-a) mol/L
) mol/L B. (2b-a) mol/L
C. (5b-![]() ) mol/L D. (10b-5a) mol/L
) mol/L D. (10b-5a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A. D元素处于元素周期表中第3周期第ⅥA族
B. 四种元素的原子半径:A<B<C<D
C. B、D的最高价氧化物具有相似的物理性质和化学性质
D. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+ D. Cu、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
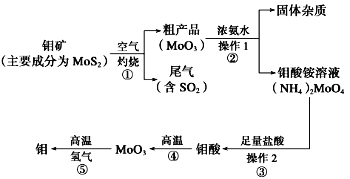
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
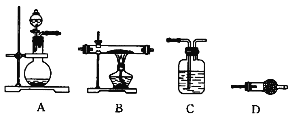
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年世界地球日宣传主题为“珍爱美丽地球 守护自然资源”。下列做法不符合这一主题的是
A. 超量开采稀土资源,满足全球市场供应
B. 推广清洁能源汽车,构建绿色交通体系
C. 合理处理废旧电池,进行资源化再利用
D. 科学施用化肥农药,避免大气和水污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com