
【题目】某学习小组按如下实验流程探宄海带中碘含量的测定和碘的制取。

已知:己知:3I2+6NaOH=5NaI+NaIO3+3H2O 请回答:
(1)实验中仪器的名称:A__________,B___________。
(2)①与②的操作名称__________________(填“相同”或“不相同”)
(3)步骤X为向海带原液中滴加0.0100mol/LAgNO3溶液,当海带原液中不再生成沉淀时,消耗 AgNO3溶液20.00mL,计算得海带中碘的百分含量为___________。
(4)步骤Y中,萃取后分液漏斗内观察到的现象是_____________________________________。
(5)方案甲中采用蒸馏不合理,理由是___________。
(6)下列有关步骤Z的说法,正确的是___________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C. NaOH溶液可以由乙醇代替
【答案】 坩埚 500 mL容量瓶 相同 1.27% 液体分为上下两层,下层呈紫红色 碘易升华,会导致碘的损失 AB
【解析】(1)根据仪器的构造可知,用于灼烧海带的仪器A为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶。(2)步骤①和②均是固体和液体的分离,都是过滤操作。(3)当加入20mL硝酸银溶液时,滴定达到终点,此时消耗硝酸银的物质的量是0.0002mol,则碘离子的物质的量是0.0002mol,所以海带中碘的百分含量为![]() ×500mL/50mL×100%=1.27%;(4)碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤Y向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色;(5)由于碘单质易升华,会导致碘的损失,因此不采用蒸馏法。(6)A.发生反应3I2+6NaOH=5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,A正确;B.根据反应3I2+6NaOH=5NaI+NaIO3+3H2O可知,步骤Z将碘转化成离子进入水层,B正确;C.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,C错误;答案选AB。
×500mL/50mL×100%=1.27%;(4)碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤Y向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色;(5)由于碘单质易升华,会导致碘的损失,因此不采用蒸馏法。(6)A.发生反应3I2+6NaOH=5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,A正确;B.根据反应3I2+6NaOH=5NaI+NaIO3+3H2O可知,步骤Z将碘转化成离子进入水层,B正确;C.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,C错误;答案选AB。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列电解质的电离方程式错误的是( )
A. HCl =H++C1- B.NaOH =Na++O2-+ H+
C.BaCl2 =Ba2++2C1- D.CuSO4=Cu2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 二氧化硫溶于水能导电,故二氧化硫属于电解质
B. 硫酸钡难溶于水,故硫酸钡属于弱电解质
C. 硫酸是强电解质,故纯硫酸能导电
D. 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A. 常温时硅可和强碱及强酸溶液反应
B. 硅与任何酸都不反应
C. 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
D. 硅的性质很稳定,能以游离态存在于自然界
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
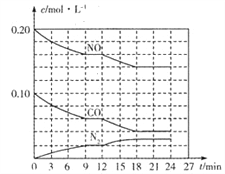
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2mol C和1mol He,此时K 停在0处,发生反应2A(g)+B(g)![]() 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是( )

A.达平衡后,K最终停留在左侧刻度0~2之间
B.若平衡时K在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机或有机含氧酸分子去掉一个或多个羟基后剩余结构称为酰基,如“—SO2—”称为硫酰(基),SOCl2、SO2Cl2、COCl2分别称为亚硫酰氯、硫酰氯和碳酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸、都可作氯化剂等。回答下列问题:
(1)已知:SO2(g)+PCl5(s)![]() SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
SOCl2(l)+POCl3(l) ΔH1=a kJ·mol1
PCl5(s)+H2O(l)![]() POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
POCl3(l)+2HCl(g) ΔH2=b kJ·mol1
则反应SOCl2(l)+H2O(l)![]() SO2(g)+2HCl(g) ΔH3=_________ kJ·mol1(用含a、b的代数式表示)。
SO2(g)+2HCl(g) ΔH3=_________ kJ·mol1(用含a、b的代数式表示)。
(2)①在1 L的密闭容器中充入1 mol SO2和2 mol Cl2,发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(l)。
SO2Cl2(l)。
反应达平衡后,其他条件不变,减小压强,请在下图中画出改变条件后反应速率随时间的变化曲线图。

②再次达平衡后测得SO2的转化率为35%。反应后向密闭容器中注入足量的BaCl2溶液,最终生成沉淀的质量为__________g。
(3)一定条件下存在反应:CO(g)+Cl2(g)![]() COCl2(g)ΔH=108 kJ·mol1,现有3个体积均为
COCl2(g)ΔH=108 kJ·mol1,现有3个体积均为
10 L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下所示投料,并在150℃条件下开始反应达平衡。
密闭容器Ⅰ(绝热恒容):1 mol CO,1 mol Cl2
密闭容器Ⅱ(恒温恒容):1 mol COCl2
密闭容器Ⅲ(恒温恒容):1 mol CO,1 mol Cl2
①容器Ⅰ中CO的转化率与容器Ⅱ中COCl2的转化率之和_____________(填“>”“<”或“=”)1;容器Ⅱ反应的化学平衡常数为K1,容器Ⅲ的化学平衡常数为K2,K1与K2的关系为_____________。
②容器Ⅲ中反应前总压强为1 atm,反应后的总压强为0.75 atm,则反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com