
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
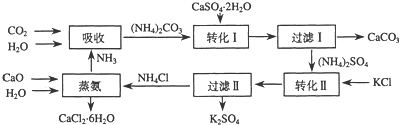
分析 由流程图可知,吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)根据箭头的方向判断不难得出最初的原料.加入的原料箭头指向方框;箭线上面的物质为中间产物,箭头指向的产物.
流程图分析:
吸收环节:2NH3+CO2+H2O生成碳酸铵;
转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;
转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;
蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤,得到碳酸钙与硫酸铵;CaSO4微溶且为悬浊液、CaCO3不溶,所以二者在离子方程式中均不拆;然后配平即可;
(3)过滤Ⅰ操作所得固体中,除CaCO3外还主要含有过量微溶的CaSO4;
(4)根据碳酸根离子与酸反应能生成二氧化碳考虑;
(5)根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算;
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关;
(7)根据绿色化学的特点进行分析.碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中.
解答 解:(1)由流程图可知,吸收环节:2NH3+CO2+H2O生成碳酸铵;转化Ⅰ环节:碳酸铵和石膏悬浊液反应生成CaCO3+(NH4)2SO4,经过滤后分离;转化Ⅱ:(NH4)2SO4和KCl的饱和溶液反应得到NH4Cl和K2SO4经过滤Ⅱ分离;蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
故答案为:CaCO3(或CaO)、NH3、H2O;
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤得到碳酸钙与硫酸铵,CaSO4微溶且为悬浊液、CaCO3不溶,所以在离子方程式中均不拆;然后配平即可;故答案为:CaSO4+CO32-=CaCO3+SO42-;
(3)CaSO4微溶且为悬浊液,故过滤Ⅰ操作所得固体中,除CaCO3外还主要含有过量微溶的CaSO4,
故答案为:CaSO4;
(4)碳酸根离子与酸反应能生成二氧化碳,所以可以用稀盐酸来验证碳酸根离子.
故答案为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-;
(5)根据图表不同温度下的溶解度,结合饱和溶液质量之比等于析出晶体质量之比计算,(100+18.2):(18.2-7.4)=591:x
x=54g;
故答案为:54;
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与易溶于水,能导电无关,
故答案为:ad;
(7)由绿色化学的特点可知,碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中);
故答案为:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).
点评 本题为工艺流程题,涉及原料、产品的判断、方程式的书写、检验、绿色化学等.做推断题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
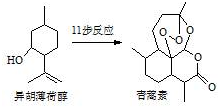 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 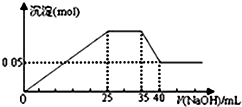 如图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 | |
| B. |  如图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 | |
| C. | 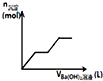 如图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 | |
| D. | 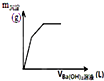 如图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
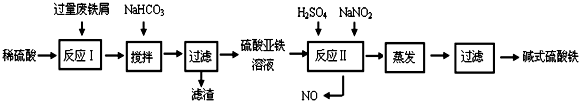
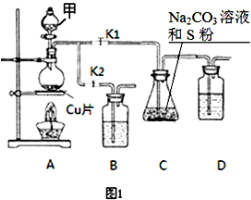 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.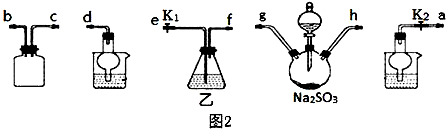
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
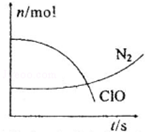
| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com