
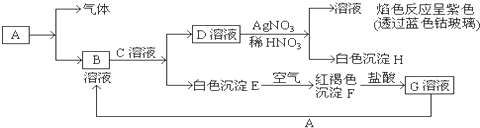
分析 依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe,结合对应物质的性质和题目要求解答该题.
解答 解:依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe,
(1)依据推断可知B的化学式为:FeCl2,C的化学式为:KOH,D的化学式为:KCl;
故答案为:FeCl2;KOH;KCl;
(2)E(Fe(OH)2)转变成F(Fe(OH)3)的反应是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)G为FeCl3,把KSCN加到G溶液中的现象是溶液呈现血红色,A为Fe,向G溶液加入A的有关离子反应方程式为Fe+2Fe3+=3Fe2+,
故答案为:溶液呈现血红色;Fe+2Fe3+=3Fe2+;
(4)焰色反应是 物理变化,经过焰色反应试验后的铂丝可在盐酸中清洗,故选B,
故答案为:物理;B.
点评 本题考查了无机物的推断,为高考常见题型,侧重于学生的分析能力和物质性质的应用,主要考查反应现象的判断应用,铁及其化合物的性质应用,现象分析是解题关键,难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Br2通入足量NaOH溶液充分反应转移电子数为0.5NA | |
| B. | 60 g SiO2中所含Si-O键数为2NA | |
| C. | 常温常压下,5.6 g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA | |
| D. | 1 mol/L 13CH3OH溶液中溶质含有的中子数为15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
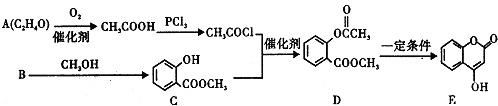
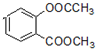 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.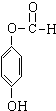 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com