
| A. | 利用金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
分析 A.丁酸含有羧基,可与钠反应;
B.二者属于同分异构体,相对分子质量相同;
C.红外光谱法确定有机物中的化学键和官能团;
D.磁共振氢谱可确定分子中有几种位置的H.
解答 解:A.乙酸乙酯含有酯基,与钠不反应,而丁酸含有羧基,可与钠反应,可鉴别,故A正确;
B.二者属于同分异构体,相对分子质量相同,用质谱法不能鉴别,故B错误;
C.红外光谱法确定有机物中的化学键和官能团,乙酸乙酯和丁酸中的化学键、官能团不同,可鉴别,故C正确;
D.核磁共振氢谱可确定分子中有几种位置的H,乙酸乙酯中只有3种位置的H,而丁酸中有4种位置的H,可鉴别,故D正确.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握二者结构的差异、性质的差异为解答的关键,注意红外光谱法、核磁共振氢谱均为确定有机物结构常用的方法,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
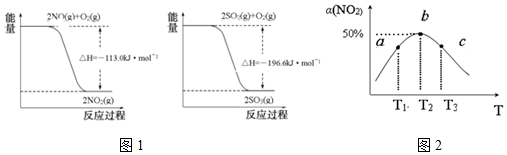
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
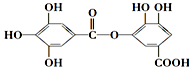
| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
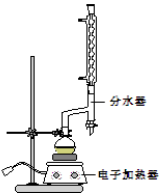 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: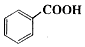 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$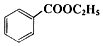 +H2O
+H2O| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com