
某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
科目:高中化学 来源:2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷(解析版) 题型:选择题
外围电子构型为4f75d16s2的元素在周期表中位置应是哪一族( )
A.第4周期ⅦB族
B.第5周期ⅢB族
C.第6周期ⅦB族
D.第6周期ⅢB族
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二3月学生学业能力调研化学试卷(解析版) 题型:推断题
下面是几种有机化合物的转换关系:
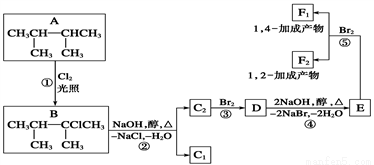
请回答下列问题:
(1)根据系统命名法,化合物A的名称是__________。
(2)上述框图中,①是__________反应,③是__________反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_________________________________________________________________。
(4)C2的结构简式是________________,F1的结构简式是__________________,
F1和F2互为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二3月学生学业能力调研化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A. 分子式为C4H8有机物最多存在4个C—C单键
B. 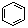 和
和 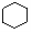 均是芳香烃,
均是芳香烃,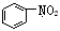 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C.  和
和 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D.  的核磁共振氢谱中有6种峰
的核磁共振氢谱中有6种峰
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三3月教学质量调测考试化学试卷(解析版) 题型:简答题
研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)=2SO3(g) △H=-198kJ·mol-1
SO2(g)+NO2(g)=SO3(g)+NO(g) △H=-41.8kJ·mol-1
若CO的燃烧热为283 kJ·mol-1,则1molNO2和1mol CO 反应生成CO2和NO的能量变化示意图中E2= _________kJ·mol-1

(2)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g) S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
S(I)+2CO2(g)。某温度下在2L恒容密闭容器中通入2 molSO2和一定量的CO发生反应,5min后达到平衡,生成1molCO2。其他条件不变时SO2的平衡转化率反应温度的变化如图A,请解释其原因:_________
②第8分钟时,保持其他条件不变,将容器体积迅速压缩至1L,在10分钟时达到平衡,CO的物质的量变化了1mol。请在图B中画出SO2浓度从6~11分钟的变化曲线。

(3)己知某温度下,H2SO3的电离常数为K1≈l.5×10-2, K2≈1.0×10-7,用NaOH溶液吸收SO2,当溶液中HSO3-, SO32-离子相等时,溶液的pH值约为_________
(4)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为_________,连二亚硫酸根与HNO2反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三3月教学质量调测考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 共价化合物的熔沸点都比较低
B.  、
、 、
、 三种核素可组成3种水分子
三种核素可组成3种水分子
C. H2O分子比H2S分子稳定的原因,是H2O分子间存在氢键
D. SiO2和CaCO3在高温下反应生成CO2气体,说明硅酸的酸性比碳酸强
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三3月教学质量调测考试化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是( )
A. 氯气和水反应:Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
B. 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑
C. 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. 少量二氧化硫气体通入FeCl3溶液中:2Fe3++SO2+2H2O=2Fe2++4H++SO42-
查看答案和解析>>
科目:高中化学 来源:2017届宁夏固原市高三下学期第一次月考理综化学试卷(解析版) 题型:填空题
目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3﹣Na2O,O2﹣可以在其中自由移动.
下列有关叙述正确的是( )

A. 电极a的反应式为:CH4+4O2﹣﹣8e﹣=CO2+2H2O
B. 电极b是正极,O2﹣由电极a流向电极b
C. 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b
D. 当固体电解质中有2 mol O2﹣通过时,外电路通过电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com