
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
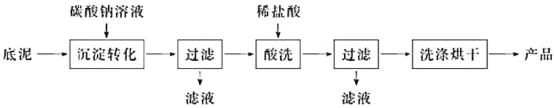
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
【答案】当滴入最后一滴NaOH标准液时,溶液由无色变为粉红色,且30s不褪色 0.0108 加入碳酸钠溶液后,溶液中的碳酸根离子与钙离子结合,转化为溶解度更小的碳酸钙沉淀,使硫酸钙的沉淀溶解平衡向溶解方向移动 氟化钙微溶于稀盐酸,在酸洗过程中有部分损失
【解析】
(1)待测液用酚酞作指示剂,滴加的标准液为NaOH,终点时,再滴入时则碱过量,溶液显浅红色;根据c1×V1=c2×V2计算;
(2)①硫酸钙微溶于水,碳酸钙难溶于水,加入碳酸钠溶液后,破环硫酸钙的溶解平衡;
②已知氟化钙微溶于无机酸,酸洗时少量溶解,质量减少。
(1)滴定终点的判断方法为:当滴入最后一滴NaOH标准液时,溶液由无色变为粉红色,且30s不褪色;根据c1×V1=c2×V2,c(HF)=0.0100mol/L×27mL/25mL=0.0108mol/L;
(2)①硫酸钙微溶于水,碳酸钙难溶于水,加入碳酸钠溶液后,溶液中的碳酸根离子与钙离子结合,转化为溶解度更小的碳酸钙沉淀,使硫酸钙的沉淀溶解平衡向溶解方向移动,最终转变为碳酸钙;
②已知氟化钙微溶于无机酸,在用盐酸洗涤时,少量溶解,因此质量减少。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
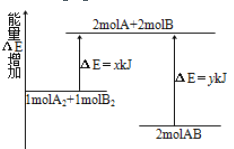
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是
A. 甲烷、苯、乙醇和乙酸均不能使酸性高锰酸钾溶液褪色
B. C4H8Cl2有9种同分异构体(不含立体异构)
C. 双糖、多糖、油脂和蛋白质都能发生水解反应
D. 石油经裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
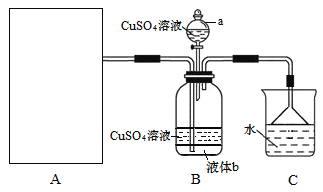
回答下列问题:
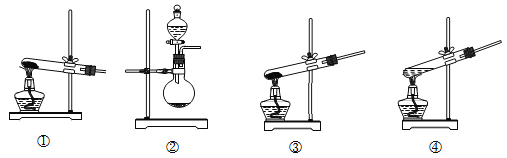
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
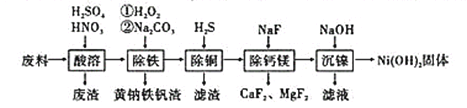
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com