
【题目】用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
(3)D是由两种元素组成的三原子分子,电子式是
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
(5)E+F→C+D写出该方程式 .
【答案】
(1)Na+
(2)NH3
(3)![]()
(4)Al3++3OH﹣=Al(OH)3↓Al(OH)3+OH﹣=AlO2﹣+H2O
(5)NH4++OH﹣=NH3+H2O
【解析】解:含有10个电子的微粒有:CH4、NH3、H2O、HF、NH4+、OH﹣、H3O+、O2﹣、F﹣、Na+、Mg2+、Al3+等,则(1)A离子为单核离子且A原子在所在周期中原子半径最大,则A为Na元素,A离子是Na+ , 所以答案是:Na+;(2)由两种元素组成的分子,其水溶液呈碱性的物质是NH3 , 所以答案是:NH3;(3)由两种元素组成的三原子分子为H2O,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,则B为Al3+ , F为OH﹣ , 反应的离子方程式分别有:Al3++3OH﹣=Al(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+H2O,所以答案是:Al3++3OH﹣=Al(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+H2O;(5)由以上分析可知E为NH4+ , F为OH﹣ , C为NH3 , D为H2O,反应的离子方程式为NH4++OH﹣=NH3+H2O,所以答案是:NH4++OH﹣=NH3+H2O.
;(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,则B为Al3+ , F为OH﹣ , 反应的离子方程式分别有:Al3++3OH﹣=Al(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+H2O,所以答案是:Al3++3OH﹣=Al(OH)3↓,Al(OH)3+OH﹣=AlO2﹣+H2O;(5)由以上分析可知E为NH4+ , F为OH﹣ , C为NH3 , D为H2O,反应的离子方程式为NH4++OH﹣=NH3+H2O,所以答案是:NH4++OH﹣=NH3+H2O.


科目:高中化学 来源: 题型:
【题目】150℃时,向下图所示的恒压容器中加入4LN2和 H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),正反应放热。反应后恢复到原温度。平衡后容器体轵变为3.4L,容器内气体对相同条件的氢气的相对密度为5。

(1)反应前混合气体中V(N2):V(H2)=______;反应达平衡后V(NH3)=__L;该反应中N2转化率为___。
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。请回答:充入NH3时,混合气体的密度将__________(填“增大”、“减小”或“不变”),在达到平衡的过程中,混合气体的密度将____(填“增大”、“减小”或“不变”)。反应重新达平衡昀混合气体对氢气的相对密度将______5(填“>”、“<”或 “ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿主要成分是A12O3,含杂质SiO2、Fe2O3。 工业上从铝土矿中提取铝可采取如下工艺流程:
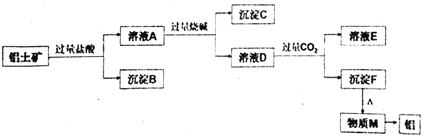
请回答下列问题:
(1)写出铝土矿溶解于过量盐酸的离子方程式___________________________________。
(2)写出溶液A中加过量烧碱的离子方程式___________________________________。
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 阳离子核外无电子 |
B | 最高正价和最低负价的绝对值之差为2 |
C | 最外层电子数是内层电子数的3倍 |
D | 1molD单质能与冷水反应,在标准状况下生成11.2LH2 |
E | 原子最外层电子数等于其周期序数 |
F | 负二价阴离子的电子层结构与Ar原子相同 |
(1)F的简单离子的结构示意图为;
(2)E在周期表中的位置为;
(3)C和D简单离子的半径大小为;(用离子符号和“>”、“=”或“<”表示)
(4)元素非金属性强弱比较有很多方法,其中C和F的非金属性强弱的研究方案中不可行的是(填序号); a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)A、C、D三种元素组成的化合物中含有的化学键为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
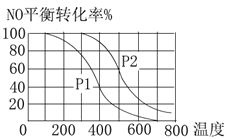
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”或“减小”)。
(2)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),已知随温度升高,此混合气体的颜色变深。
2NO2(g),已知随温度升高,此混合气体的颜色变深。
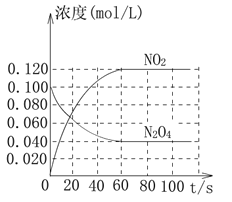
回答下列问题:
①反应的ΔH_________________________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为____________mol·L-1·s-1;反应的平衡常数K1为____________________。
②100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。列式计算温度T时反应的平衡常数K2=_________________。
③温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本地震引起的核泄漏中放射性物质主要是Cs和131I,其中有关127I与131I的说法正确的是( )
A. 127I与131I互为同位素 B. 127I与131I互为同素异形体
C. 127I与131I是同分异构体 D. I与Cl均属ⅦA族,I比Cl活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是
p C(g) △H,在密闭容器中进行,下图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线。由曲线分析,下列判断正确的是

A. T1<T2,P1>P2,m+n>p,△H<0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1<T2,P1>P2,m+n<p,△H<0
D. T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com