
下列判断错误的是( )
A.沸点:NH3>PH3>AsH3
B.熔点:SiO2>NaCl>CH4
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH) 2>Al(OH)3
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:2015-2016学年广东省惠州市高一下学期期中考试化学试卷(解析版) 题型:选择题
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于这两种物质的说法正确的是( )
A.炒菜时放入食盐并不破坏NaCl中的离子键
B.HCl的电子式是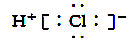
C.HCl是共价化合物,但溶于水时电离出H+和Cl-
D.NaCl熔化时破坏共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列实验装置能达到实验目的是(夹持仪器未画出) ( )
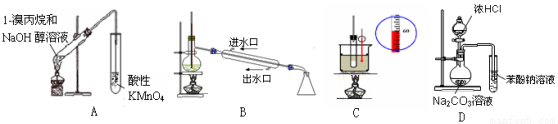
A.A装置用于检验溴丙烷消去产物
B.B装置用于石油的分馏
C.C装置用于实验室制硝基苯
D.D装置可装置证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;
(2)写出A、B、C形成的化合物M的电子式________;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;在同主族元素氢化物的递变性质中,B的氢化物沸点反常,这可以用________来解释。
(4)写出两个由这五种元素中的两种形成的18电子体的结构式:________。
(5)D单质与M的水溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.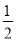 N2H4(g)+
N2H4(g)+ O2(g) ===
O2(g) ===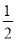 N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g) === N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g) === N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g) === N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是( )
A.39K+和40Ca2+微粒中的电子数和中子数都相等
B.D2和He在同温同压时,若体积相等,则质量相等
C.同一元素的各种同位素的物理性质、化学性质均不相同
D.两个质量数和电子数都相等的微粒不一定是同种元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:实验题
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,______与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为________________________________________________。
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由。________________ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
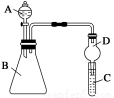
(4)仪器B的名称为________,干燥管D的作用为____________。
(5)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_______________________
__________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:选择题
日本福岛核电站的核原料铀?235(235 92U)裂变释放出具有放射性的碘?131(I)和铯?137(Cs),下列说法正确的是
A.127I与131I互为同素异形体 B.137Cs的核电荷数为137
C.铀?235的中子数是143 D.铯与水的反应比钠与水的反应缓慢
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三考前训练一理综化学试卷(解析版) 题型:填空题
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量。
Ⅰ.CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应②:CO2(g)+H2(g)  CO (g)+H2O(g)△H2
CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)  CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
(1)反应②的△H2= ,反应 ① 自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)某温度下,在体积为2 L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①。一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示。
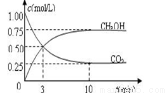
①前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为
(结果保留两位小数) 。
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
E.再充入1 mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡
(填“正向”、“逆向”或“不”)移动。
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4)。氨基甲酸铵极易发生:H2NCOONH4+2H2O  NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
NH4HCO3+NH3·H2O,该反应酸性条件下更彻底。25℃,向l L 0.1 mol·L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052 mol氨基甲酸铵。若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=____________,NH4+水解常数Kh=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com