
分析 (1)①KMnO4与Cu2S反应中,Mn元素的化合价降低5,Cu、S元素的化合价升高,共升高8,结合电子、电荷及原子守恒配平;
②KMnO4与CuS反应中,Mn元素的化合价降低5,S元素的化合价升高,升高6,结合电子、电荷及原子守恒配平;
③KMnO4与(NH4)2Fe(SO4)2溶液反应中,Mn元素的化合价降低5,Fe元素的化合价升高,升高1,结合电子、电荷及原子守恒配平;
(2)二氧化硫具有还原性,高锰酸钾具有强氧化性,Cu2S和CuS的混合物在酸性溶液中用0.150mol•L-1KMnO4溶液处理后,溶液需要煮沸赶尽SO2;
(3)根据金属化合物的质量和金属化合物与高锰酸钾反应的高锰酸钾的物质的量列方程式组,计算出硫化铜的质量,再根据质量分数计算方法计算即可.
解答 解:(1)①KMnO4与Cu2S反应中,Mn元素的化合价降低5,Cu(+1→+2)、S(-2→+4)元素的化合价升高,共升高8,由电子、电荷及原子守恒可知,离子反应为8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
故答案为:8、5、44、10、5、8、22;
②KMnO4与CuS反应中,Mn元素的化合价由+7降到+2,降低5价;S元素的化合价由-2升高到+4价,升高6价,最小公倍数为30;再根据质量守恒得到H2O的系数为14,H+的系数为28,离子反应为:6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;
故答案为:6、5、28、5、5、6、14;
③Mn元素的化合价由+7降到+2,降低5价;Fe元素的化合价由+2升高到+3价,升高1价,最小公倍数为5;再根据质量守恒得到H2O的系数为4,H+的系数为8,离子反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:1、5、8、1、5、4;
(2)二氧化硫具有还原性,高锰酸钾具有强氧化性,Cu2S和CuS的混合物在酸性溶液中用0.150mol•L-1KMnO4溶液处理后,溶液若不煮沸,则溶液中的SO2与KMnO4溶液反应5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,无法准确测定混合物中CuS的质量分数,
故答案为:若不煮沸赶尽SO2,溶液中的SO2与KMnO4溶液反应,无法准确测定混合物中CuS的质量分数;
(3)高锰酸钾的总物质的量为0.0400L×0.15mol/L=0.006mol,剩余的KMnO4恰好与50.00mL0.200mol•L-1(NH4)2Fe(SO4)2溶液完全反应MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,剩余的KMnO4的物质的量为0.0500L×0.2mol/L×$\frac{1}{5}$=0.002mol,则用0.150mol•L-1KMnO4溶液处理Cu2S和CuS的混合物时消耗高锰酸钾的物质的量为:0.006mol-0.002mol=0.004mol,设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+5Cu2S+44H+═10Cu2++5SO2+8Mn2++22H2O,
$\frac{8}{5}$mmol mmol
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
$\frac{6}{5}$nmol nmol
所以列方程组为:$\left\{\begin{array}{l}{160m+96n=0.35g\\;}\\{\frac{8}{5}m+\frac{6}{5}n=0.004mol}\end{array}\right.$
解之得:x=$\frac{0.0075}{8}$mol y=$\frac{0.05}{24}$mol,所以CuS的质量为$\frac{0.05}{24}$×96g/mol=0.2g,
CuS的质量分数为$\frac{0.2g}{0.35g}$×100%≈57.1%,
答:混合物中CuS的质量分数为57.1%.
点评 本题考查氧化还原反应计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应计算及转移电子的考查,注意从化合价角度分析,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂质量轻、比能量大,可用作电池负极材料 | |
| B. | 某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2 | |
| C. | 酒精是良好的有机溶剂,可洗去皮肤表面沾有的苯酚 | |
| D. | 漂白粉在水溶液中能够生成次氯酸,可用于漂白纸张 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2具有氧化性和导电性,故可作为铅蓄电池的负极材料 | |
| B. | 炭具有还原性,一定条件下能 将二氧化硅还原为硅 | |
| C. | 酒精能使蛋白质溶液沉淀析出,可以用来分离提纯蛋白质溶液 | |
| D. | Al的金属较强,可用作飞机火箭的结构材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
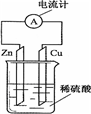
| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、CO32-、NO3-、K+ | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | Ag+、Al3+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0句 | B. | 1句 | C. | 2句 | D. | 3句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com