
下列说法中不正确的是: ( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
C.由水电离出来的c(H+) = 1×10-13 mol/L的溶液中:K+、CO32-、Cl-、NO3-可能大量共存
D.使石蕊变红的溶液中: Na+、I-、Cl-、NO3-可能大量共存
【知识点】离子反应、物质的性质
【答案解析】D 解析:A、维生素C具有还原性,容易被氧化,所以在人体内起抗氧化作用,故A正确;B、硫酸亚铁具有还原性,可防止月饼等富脂食品氧化变质,故B正确;C、由水电离出来的c(H+) = 1×10-13 mol/L的溶液呈酸性或碱性,溶液呈酸性时CO32-不能大量共存,溶液呈碱性时K+、CO32-、Cl-、NO3-可以大量共存,故C正确;D、使石蕊变红的溶液呈酸性: I-、NO3-因发生氧化还原反应不能大量共存,故D错误;
故答案选D
【思路点拨】本题主要考查离子反应的知识,注意题目中的前提条件:由水电离出来的c(H+) = 1×10-13 mol/L的溶液呈酸性或碱性,使石蕊变红的溶液呈酸性。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列物质的分类正确的是( )
A.共价化合物——硫酸、纯碱、水
B.分散系——空气、水玻璃、盐酸
C.非电解质——液氯、乙醇、NH3
D.强氧化剂——盐酸、硫酸、硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实方案
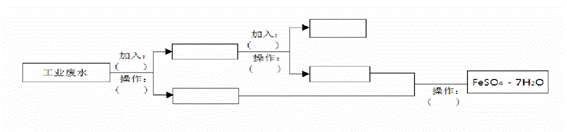
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件下,离子能大量共存或者离子方程式正确的是
A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42-
B.在含较多Al3+的溶液中:K+、Cl-、HCO3-
C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4+ +OH-=NH3·H2O
D.向小苏打溶液中加入NaOH固体:HCO3- + OH-=CO32- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲探究食品添加剂铵明矾NH4Al(SO4)2·12H2O高温分解的情况。
(1)预测产物:下列关于气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)定性检验:取一定量铵明矾,设计下列实验探究产物 。
①按图示组装仪器后,首先检查整套装置的气密性,操作是________。
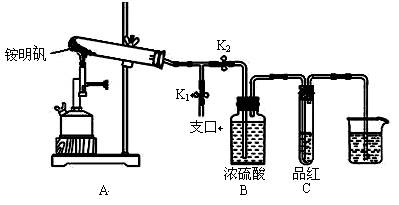
②夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是_________(任填一种物质的化学式)。
③分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式。
④为了防止倒吸,实验结束时必须先____________(填字母序号),然后熄灭酒精喷灯。
A.取出烧杯中的导管 B.打开止水夹K1 C.关闭止水夹K2
(3)分析和结论:实验证明气体产物是(1)D中的5种气体。相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH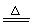 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。请完成FeO42-与水反应的方程式:4FeO42-+10H2O  4Fe(OH)3+8OH-+( )
4Fe(OH)3+8OH-+( )
(3)K2FeO4在处理水的过程中能消毒杀菌是因为① ,
它能净水的原因是② 。
(4) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
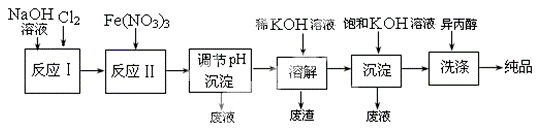
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在水溶液中能大量共存的一组离子是 ( )
A.Ca2+、Al3+、Br-、CO3- B.Pb2+、Hg2+、S2-、SO3-
C. N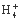 、H+、S2
、H+、S2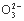 、P
、P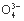 D.Na+、Ba2+、Cl-、NO3-
D.Na+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
. 图中A-J均为有机化合物,根据图中的信息,回答下列问题:
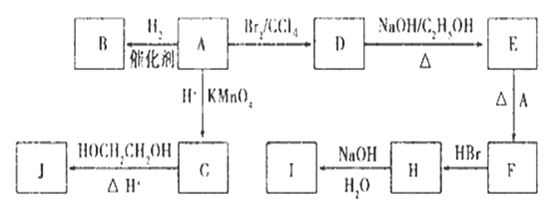
(1)环状化合物A的相对分子质量为82,其中含碳87. 80%,含氢12. 20%。B的一氯代物仅有一种,B的结构简式为 ;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为 ;
(3)由A生成D的反应类型是___________,由D生成E的反应类型是_______ _____;
(4)(3分)C的分子式为C6H10O4,0.146 g G需用20 mL0.100 mol/L NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为:
_______ ___
(5)H中含有的官能团是(名称)________,I中含有的官能团是(名称)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:
MnO4-+C2O42-+H+-→CO2↑+Mn2++ ,
关于此反应的叙述正确的是 ( )
A.该反应的氧化剂是C2O42-
B.该反应右边方框内的产物是OH-
C.该反应中生成1molCO2电子转移数总是5NA
D.配平该反应式后,H+的系数是16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com