

分析 (1)根据构造原理最后填入电子的能级的符号将元素周期表分为s、p…等区域;
(2)A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A原子各层电子数依次为2、8、11、2,B原子各层电子数依次为2、8、18、6;
(3)X为Cu元素,由晶胞晶胞可知,晶胞中小球有4个,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则该化合物为CuH,在氯气中燃烧生成CuCl2与HCl;除外Cu,第四周期中最外层只有一个电子的核外电子排布为[Ar]4s1[Ar]3d54s1;
(4)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素.
解答 解:(1)根据构造原理最后填入电子的能级的符号将元素周期表分为s、p…等区域,
故答案为:根据构造原理最后填入电子的能级的符号;
(2)A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A原子各层电子数依次为2、8、11、2,B原子各层电子数依次为2、8、18、6,A原子核外电子排布式为1s22s22p63s23p63d34s2,B处于周期表中第四周期第VIA族,
故答案为:1s22s22p63s23p63d34s2;第四周期第VIA族;
(3)X为Cu元素,由晶胞晶胞可知,晶胞中小球有4个,大球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则该化合物为CuH,在氯气中燃烧生成CuCl2与HCl,反应方程式为:2CuCl+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;除外Cu,第四周期中最外层只有一个电子的核外电子排布为[Ar]4s1、[Ar]3d54s1,分别为:钾与铬,
故答案为:2CuCl+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl;钾、铬;
(4)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素,画出金属和非金属的分界线为: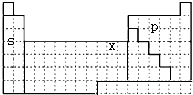 ,
,
故答案为: .
.
点评 本题考查元素周期表、核外电子排布、晶胞计算等,有利于基础知识的巩固,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | “酸可除锈”、“纯碱溶液可去油污”都发生了化学变化 | |
| B. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Fe |
| 电解质溶液 | HNO3 | H2SO4 | HCl | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题: ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用. | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 | |
| C. | 日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 | |
| D. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素性质[] | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )| A. | +882 kJ•mol-1 | B. | +441 kJ•mol-1 | C. | -882 kJ•mol-1 | D. | -441 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com