
 2NaOH��H2����Cl2����֪��ÿ����1mol�������Ʒ�Ӧ�о�ת��1mol���ӣ���˷�Ӧ�����ɵ�����������0.1mol����Ũ����0.1mol/L��������Һ��������Ũ����10��13mol/L����pH��13��
2NaOH��H2����Cl2����֪��ÿ����1mol�������Ʒ�Ӧ�о�ת��1mol���ӣ���˷�Ӧ�����ɵ�����������0.1mol����Ũ����0.1mol/L��������Һ��������Ũ����10��13mol/L����pH��13��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
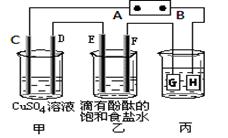
| A��װ���ҵ�a��Ҫ��װ�ü�X������ |
| B��װ������b���ĵ缫��ӦʽΪ2Cl����2e��=Cl2�� |
| C�����л���ˮ����Ҫ���������ǣ���װ�ü���M�������ĵ缫ӦΪC6H12O6��6H2O��24e��=6CO2����24H�� |
| D��N�缫������ԭ��Ӧ����N�缫����5.6 L(��״����)����ʱ������2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 R2Cu(�л���)+2H��(ˮ��)������л��࣬�����м���һ��Ũ�ȵ����ᣬʹCu2+���������� �����������ͭ��Һ�Ƶý���ͭ��
R2Cu(�л���)+2H��(ˮ��)������л��࣬�����м���һ��Ũ�ȵ����ᣬʹCu2+���������� �����������ͭ��Һ�Ƶý���ͭ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
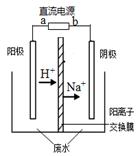
| A����Ϊ���ᣬpH��С | B����Ϊ����������Һ��pH��С |
| C����Ϊ��������Һ��pH���� | D����Ϊ�Ȼ�����Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
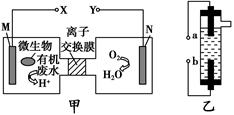
| A������CH4������ȼ�ϵ��Ϊֱ����Դ��ȼ�ϵ�ص�b��Ӧͨ����� |
| B���������У�������Na2SO4�����ʵ������� |
| C��������ӦCH3CHO -2e- + 2H+="=" CH3COOH + H2O |
| D���������У��������ֱ�����������Ҵ��⣬����������ɫ���壬��������������O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
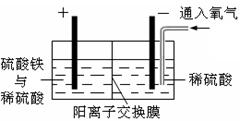
| A������Cu�����ʵ�����0.1 mol |
| B��ת�Ƶ��ӵ����ʵ�����0.2 mol |
| C�����ŵ��Ľ�����Һ��pH��С |
| D��������Ӧʽ��4OH-��4e-��2H2O��O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe3+ | B��Br- | C��Cu2+ | D��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.5 mol/L | B��0.8 mol/L | C��1 mol/L | D��1.5 mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com