
 发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:
发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:分析 Ⅰ、镓的原子序数为31,根据能量最低原理和洪特规则书写电子排布式;
Ⅱ、利用均摊法确定其化学式;
Ⅲ、从氢键以及影响分子间作用力的因素比较氢化物熔沸点的高低;
Ⅳ、根据价层电子对数计算杂化类型;
Ⅴ、根据ρ=$\frac{m}{V}$,计算求解.
解答 解:Ⅰ、镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,
故答案为:1s22s22p63s23p633d104s24p1;
Ⅱ、该晶胞中,Ga原子个数=4,As原子个数=$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,所以其化学式为:GaAs,故答案为:GaAs;
Ⅲ、由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,
故答案为:NH3>AsH3>PH3;
Ⅳ、由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为:sp2;
Ⅴ、该晶胞中,Ga原子个数=4,As原子个数=$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,所以ρ=$\frac{m}{V}$=$\frac{\frac{4}{{N}_{A}}×145}{(a×1{0}^{-10})^{3}}$g/cm3,故答案为:$\frac{\frac{4}{{N}_{A}}×145}{(a×1{0}^{-10})^{3}}$.
点评 本题考查晶胞的计算、沸点的比较及第一电离能的大小比较等知识,题目难度中等,本题注意晶胞的计算方法和元素周期律的利用.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 标准状况下,22.4LCO2与CO的混合气体含NA个分子 | |
| C. | lmolNa2O2与足量CO2反应转移的电子数为2NA | |
| D. | 常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
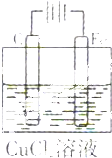
| A. | C棒是阴极 | B. | Cu2+向C棒电极移动 | ||
| C. | Fe电极发生还原反应 | D. | 溶液颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使溴水褪色 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 将苯加入溴水中,因苯能与溴水发生加成反应而使溴水褪色 | |
| D. | 50~60℃时,在浓硫酸存在下,苯能与浓硝酸反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.
CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素基态原子的电子排布图: | |
| B. | Mg的基态原子电子排布式为:1s22s22p43s23p1 | |
| C. | ${\;}_{8}^{18}$O2-的结构示意图: | |
| D. | 过氧化氢的结构式:H-O-O-H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com