
【题目】下列说法正确的是( )
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea)kJ/mol
B.反应CH4(g)+H2O(g)═CO(g)+3H2(g)在一定条件下能自发进行,该反应一定为放热反应
C.0.1 molL-1 CH3COOH溶液加水稀释,溶液中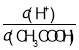 增大
增大
D.电解精炼铜时,粗铜与外接电源正极相连,电解过程中电解质溶液中的c(Cu2+)保持不变
【答案】C
【解析】
A.反应A(g)2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=正反应的活化能-逆反应的活化能=(Ea-Eb)kJmol-1,故A错误;
B.如果该反应能自发进行,则△G=△H-T△S<0,该反应的△S>0,该反应在一定条件下能自发进行,则该反应不一定是放热反应,故B错误;
C.0.1 molL-1 CH3COOH溶液加水稀释,促进CH3COOH的电离,溶液中H+的微粒数增大,而CH3COOH的数目减小,因为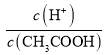 =
=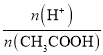 ,则溶液中
,则溶液中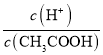 增大,故C正确;
增大,故C正确;
D.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解过程中粗铜上Cu和比Cu活泼的金属失电子被氧化,阴极上只有铜离子得电子,所以粗铜溶解的Cu质量小于阴极析出Cu的质量,则溶液中c(Cu2+)减小,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
①3.9g苯与足量的H2反应时,参与反应的碳碳双键数为0.15NA
②3.1g氧化钠和3.9g过氧化钠的混合物中含有的阴离子总数为0.1NA
③1.8g14CH4和水蒸气(H216O)的混合气体中含电子数目为NA
④常温下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含![]() 的数目相同
的数目相同
⑤常温下4.6gNO2和N2O4,混合气体中所含原子总数为0.3NA
⑥1molSiO2晶体中含有极性共价键数目为2NA
⑦将1molCl2通入足量水中,溶液中HClO、Cl、ClO粒子数之和为2NA
⑧高温下,16.8gFe与足量水蒸气完全反应转移电子数为0.8NA
A.①②④⑥B.②③⑤⑧C.②③⑥⑦D.③⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂分析人员从车间取过氧化氢样品1.00mL 于锥形瓶中,加25mL 水稀释,再用硫酸酸化后,逐滴加入0.1000mol·L-1KMnO4 溶液。当反应完全时,消耗KMnO4溶液20.20mL。试计算该过氧化氢样品的物质的量浓度_____________。(2KMnO4 + 3H2SO4 + 5H2O2 == K2SO4 + 2MnSO4 + 5O2↑ + 8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,测得1.92 g RO2某气体的体积为672 mL。
(1)该气体含分子的物质的量为__________。
(2)此气体的相对分子质量为__________。
(3)R的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应![]() 的ΔH为____________________。
的ΔH为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,气密性已检验,F是用于鼓入空气的双连打气球)。
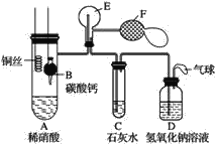
实验操作及现象为:
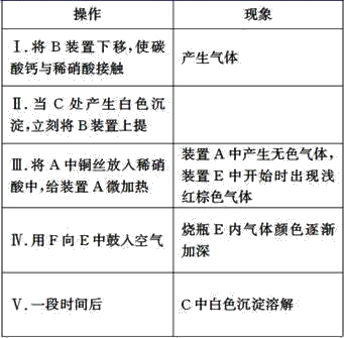
(1)操作Ⅰ中产生气体的离子反应方程式为__;
(2)操作Ⅰ的目的是__;
(3)C中白色沉淀的化学式是__,操作Ⅱ中当C产生白色沉淀时立刻将B上提的原因是__;
(4)操作Ⅲ中装置A产生无色气体的化学方程式是__;
(5)烧瓶E内气体颜色逐渐加深的原因是__;
(6)操作Ⅴ现象产生的原因是(结合化学方程式说明)__;
(7)D装置的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
①标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
②常温常压下,18gH2O中含有的原子总数为3NA
③标准状况下,11.2LCH3CH2OH中含有的分子数目为0.5NA
④常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
⑤100ml1mol/LFeCl3溶液中所含Fe3+的数目为0.1NA
⑥1LpH=1的硫酸溶液中含有H+的数目为0.1NA
A.①②④B.①②④⑤⑥C.②⑥D.②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com