
解热镇痛药贝诺酯的合成路线如下:
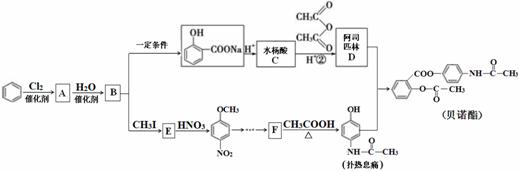
请回答下列问题:
(1)A→B的反应类型为_____________;B→E的另一产物是________。
(2)X是水杨酸的同分异构体,X中含有苯环,属于酯类,遇FeCl3溶液显紫色。则X 的结构简式为_____________(任写一种)。
(3)F中官能团的名称为________________。1mol扑热息痛与足量NaOH溶液反应,消耗NaOH的物质的量为__________。
(4)生成贝诺酯的化学方程式为______________________________。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
将7 g某铜、银合金与足量的a mol·L-1 HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56 L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
A.1.6 g B.2.4 g
C.3.2 g D.4.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
两种盐的固体混合物:①加热时 有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是 ( )
有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是 ( )
A.BaCl2和(NH4)2SO3 B.AaNO3和NH4Cl
C.FeCl3和NaHCO3 D.KCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
| B | 向溶液X中滴加BaCl2溶液 | 有白色沉淀 | X中一定含有SO42- |
| C | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐退去 | Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是__________________________________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:
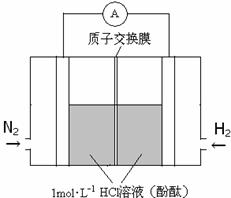
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是
A.Na+、I﹣、SO32﹣ B.Na+、Br﹣、SO32﹣
C.Fe3+、Br﹣、NO3﹣ D.Na+、Br﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的电负性从大到小排列顺序为 。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。
a.离子键 b. 配位键 c. σ键 d. π键
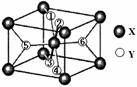 (2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是 。
a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【理综卷·2015届重庆市重庆一中高三上学期第一次月考(201409)】2.(共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
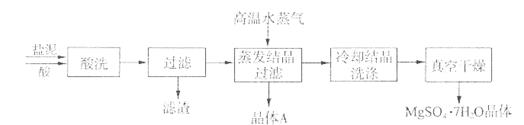
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因 。
②过滤所得滤渣的主要成分为 。
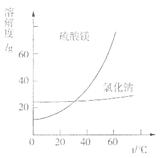
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。
④真空干燥MgSO4·7H2O晶体的原因是 。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铝的叙述中正确的是 ( )
A.铝还原性强且亲氧性强,所以可通过铝热反应冶炼高熔点金属
B.铝在空气中极易锈蚀,所以铝制品的使用时间很短
C.铝能耐稀硫酸腐蚀,所以运送稀硫酸可用铝制槽车
D.铝的导电性比铜、银更强,所以常用以制造电线、电缆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com