
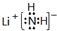 .
. CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)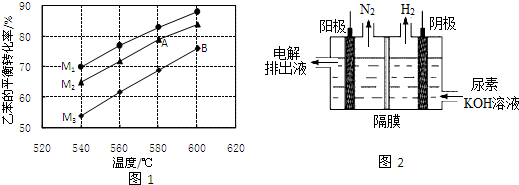
分析 (1)①LiNH2为离子化合物,是锂离子Li+和NH2-离子构成;
②Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算得到Li3N固体与氢气反转化为LiNH2的热化学方程式;
(2)①用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,该反应的平衡常数计算式等于生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积,分压=总压×物质的量分数;
②随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高;
③乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳;
(3)根据图2可知:该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;生成氢气的电极是阴极.
解答 解:(1)①LiNH2为离子化合物,是锂离子Li+和NH2-离子构成,电子式为: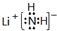 ,
,
故答案为: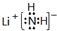 ;
;
②Ⅰ.Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Ⅱ.Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ得到Li3N固体与氢气反应转化为LiNH2的热化学方程式:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1 ,
故答案为:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1;
(2)① CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$
CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,设起始乙苯物质的量为1mol,
 CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$
CH2CH3(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
起始量(mol) 1mol 0 0
变化量(mol) 1mol×70%=0.7mol 0.7mol 0.7mol
平衡量(mol) 0.3mol 0.7mol 0.7mol
540℃下该反应的平衡常数计算式K=$\frac{\frac{0.7mol}{1.7mol}×101pa×\frac{0.7mol}{1.7mol}×101pa}{\frac{0.3mol}{1.7mol}×101pa}$=$\frac{(\frac{0.7}{1.7}×101)^{2}}{\frac{0.3}{1.7}×101}$,
故答案为:$\frac{(\frac{0.7}{1.7}×101)^{2}}{\frac{0.3}{1.7}×101}$;
②图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
③乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳,反应的化学方程式为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2.
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查了化学平衡的计算、电解池原理、平衡常数计算、图象分析应用,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
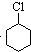 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$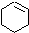 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$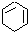 $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生气体的快慢,来反映试剂反应速率的大小.从而探究浓度温度等外界条件对该反应的化学反应速率的影响 | |
| B. | 容量瓶、滴定管上都标有使用温度和“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 | |
| C. | 油脂皂化反应后的反应液中加入饱和食盐水并搅拌后出现分层,则生成的高级脂肪酸钠在下层 | |
| D. | 只用 NaHCO3 溶液就可鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
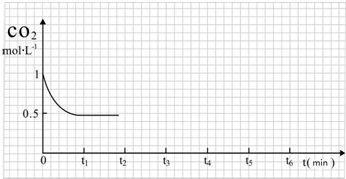
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 12 | C. | 16 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
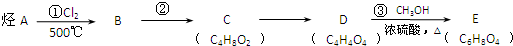
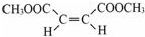 ;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
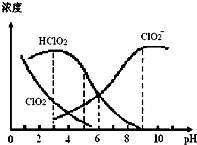 亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 不同pH的NaClO2溶液中存在下列关系:c ( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) | |
| D. | 该温度下HClO2的电离平衡常数的数值:Ka≈1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使溴水褪色,体现其漂白性 | |
| B. | NOx、CO2、PM 2.5颗粒都会导致酸雨 | |
| C. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| D. | 等质量的NaHCO3按a、b两种途径完全转化,途径a比途径b消耗更多的盐酸 途径a:NaHCO3 $\stackrel{△}{→}$Na2CO3 $\stackrel{盐酸}{→}$CO2;途径b:NaHCO3$\stackrel{盐酸}{→}$CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com