
分析 (1)根据c=$\frac{1000ρω}{M}$,结合稀释定律C浓V浓=C稀V稀求解;
(2)根据操作过程是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶等步骤来排序;
(3)容量瓶使用前要先检查是否漏液;
(4)根据C=$\frac{n}{V}$,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差.
解答 解:(1)浓硫酸的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,
设需要的浓H2SO4的体积为Vml,根据稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×Vml=3.68mol/L×500mL
解得:V=100,故答案为:100;
(2)操作过程是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶,故正确的操作顺序是:AEFDGCB,故答案为:AEFDGCB;
(3)容量瓶使用前要先检查是否漏液,故答案为:检漏;
(4)①浓硫酸溶解后未冷却至室温即进行定容,待溶液冷却后体积偏小,则浓度偏高,故答案为:偏高;
②定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故答案为:偏高;
③只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响,故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中涉及到的仪器的选择、计算、误差分析等问题,难度不大.


科目:高中化学 来源: 题型:解答题
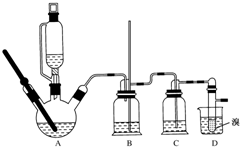 用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
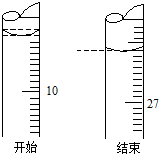 某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光柱 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com