
某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
A.Mg2+ 、Cl-、Na+、NO3- B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D.Fe3+、Na+、AlO2-、SO42-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
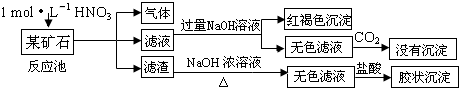
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 | b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 | d.离子半径:O2-<Al3+ |
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2012届北京市西城区高三上学期期末考试化学试卷 题型:填空题
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。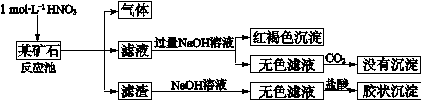
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 | b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 | d.离子半径:O2-<Al3+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省武威市高三上学期第五次月考化学试卷(解析版) 题型:填空题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。

(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市西城区高三上学期期末考试化学试卷 题型:填空题
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
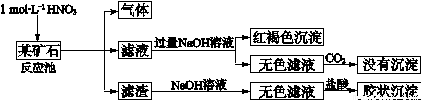
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
|
a.酸性:H2CO3>H2SiO3 |
b.原子半径:O<C<Si<Al |
|
c.稳定性:H2O>CH4>SiH4 |
d.离子半径:O2-<Al3+ |
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com