
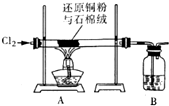
 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.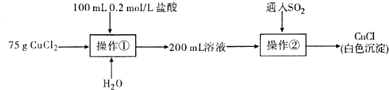
分析 I.(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;
(2)氯气有毒,所以B装置是吸收尾气;
(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜;
Ⅱ.(4)溶解时加入HCl溶液的目抑制氯化铜的水解;
(5)操作②为向含有铜离子、氯离子的溶液中通入二氧化硫气体,反应为SO2+2Cu2++2Cl-+2H2O=SO42-+2CuCl↓+4H+;
(6)根据氢原子守恒分析解答;取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立.
解答 解:I.(1)石棉绒的作用是增大铜粉与氯气反应的接触面积,
故答案为:增大铜粉与氯气的接触面积;
(2)氯气有毒,所以B装置是吸收尾气,而氯气用氢氧化钠吸收,
故答案为:NaOH溶液;
(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种,故答案为:Cu或CuCl;
Ⅱ.(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2O?Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解,
故答案为:Cu2++2H2O?Cu(OH)2+2H+,加酸抑制Cu2+的水解;
(5)操作②为向含有铜离子、氯离子的溶液中通入二氧化硫气体,反应为SO2+2Cu2++2Cl-+2H2O=SO42-+2CuCl↓+4H+,
故答案为:SO2+2Cu2++2Cl-+2H2O=SO42-+2CuCl↓+4H+;
(6)设9.8mol/LH2SO4的体积为VmL,则0.2×0.1+V×9.8×2=10×0.1,解之得V=50ml,体系中存在平衡2Cl- (aq)+CuCl(s)?CuCl32- (aq),是氯离子的浓度过大平衡正向移动,可以取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立,
故答案为:50;取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立.
点评 本题考查了铜及化合物的主要性质,涉及盐的水解平衡的应用,尾气处理以及反应方程式的书写等,试题培养了学生灵活应用所学知识的能力.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
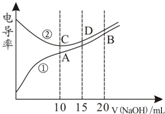 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:2c(Na+)=3c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
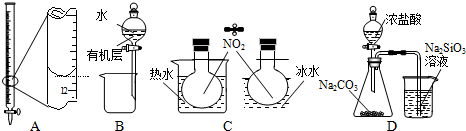
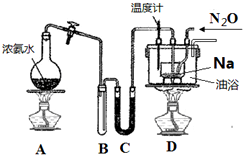
| A. | 装置A记录滴定终点读数为12.20 mL | |
| B. | 装置B可用于提取I2的CCl4溶液中的I2 | |
| C. | 装置C可用于探究温度对2NO2?N2O4平衡体系的影响 | |
| D. | 装置D可用于比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在混合液中加入氢氧化钠溶液,充分振荡后分液 | |
| B. | 在混合液中加人一定量的浓硫酸和乙醇,加热,将乙酸转化为乙酸乙酯 | |
| C. | 在混合液中加人足量的水.充分振荡后分液 | |
| D. | 在混合液中加入适量的饱和碳酸钠溶液,充分振荡后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加快反应速率 | |
| B. | 增大O2的浓度可使SO3的浓度减小 | |
| C. | 降低温度可以减小反应速率 | |
| D. | 增大SO2的浓度可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
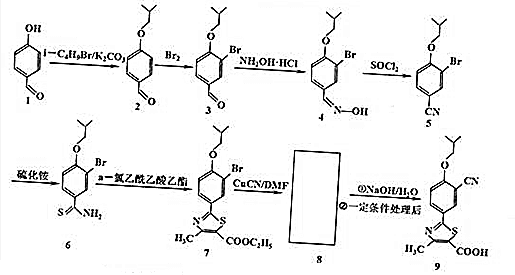
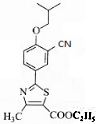 .
.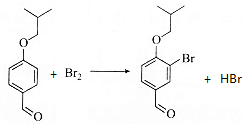 .
. .
.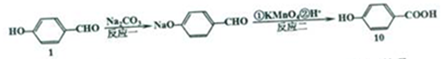
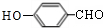 +Na2CO3→
+Na2CO3→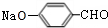 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 分子式 | C4H10O | C3H8 | C7H16 | C8H10 |
| 限定条件 | 能与钠反应 | 二氯代物 | 分子中含有3个甲基 | 芳香烃,能得到3中硝化产物 |
| 同分异构体数目 | 4 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com