
| A. | 一氧化氮 | B. | 二氧化硫 | C. | 一氧化碳 | D. | 二氧化碳 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 表示硫的燃烧热的热化学方程式S(s)+$\frac{3}{2}$O2(g)=SO3(g);△H=-315 kJ/mol | |
| B. | 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol | |
| C. | 表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8 kJ/mol | |
| D. | 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaHSO4 晶体中含阴阳离子总数是0.3NA | |
| B. | 6.2gNa2O溶入水配成1L溶液,所得溶液的物质的量浓度为0.2 mol/L | |
| C. | 11.2 L CO2和O3混合气体中含有的原子数是1.5 NA | |
| D. | 17 g H2O2完全分解,转移电子数是1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
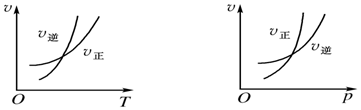
| A. | m>n,Q>0 | B. | m>n+p,Q>0 | C. | m>n,Q<0 | D. | m>n+p,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 胶体微粒不能透过滤纸 | |
| C. | 向沸水中加入Fe(OH)3可制得Fe(OH)3胶体 | |
| D. | 利用丁达尔效应可以区别溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol[ | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,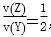 ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com