

分析 (1)根据稀释过程中溶质的物质的量不变计算需要2.5mol/L的H2SO4溶液的体积;
(2)根据配制溶液的实验操作过程进行步骤填空与实验步骤排序;
(3)实验步骤A、B、E、F都用到的仪器名称为100mL容量瓶;
(4)得到的白色沉淀是硫酸钡沉淀,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,利用硫酸根守恒计算硫酸的物质的量,再根据c=$\frac{n}{V}$计算该硫酸溶液的浓度;
分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析对所配溶液浓度的影响.
解答 解:(1)设需要2.5mol/L的H2SO4溶液的体积为V,则根据稀释过程中溶质的物质的量不变VmL×2.5mol/L=100mL×0.2mol/L,解得V=8.0mL;
故答案为:8.0;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀,故操作顺序为CBDAE;
故答案为:CBDAE;
(3)实验步骤A、B、E、F都用到的仪器名称为100mL容量瓶;
故答案为:100mL容量瓶;
(4)硫酸钡的物质的量为$\frac{0.48g}{233g/mol}$=0.0021mol,依据方程式中硫酸钡与硫酸的物质的量关系:
H2SO4~BaSO4;
1 1
所以n(H2SO4)=n(BaSO4)=0.0021mol,硫酸的物质的量浓度C=$\frac{0.0021mol}{0.01L}$=2.1mol/L,大于2mol/L;
a.定容时俯视容量瓶,导致溶液体积偏小,溶液浓度偏大,故a选;
b.用量筒取2.4mol/LH2SO4溶液时俯视读数,导致量取的浓溶液体积偏小,溶质的物质的量偏小,溶液浓度偏低,故b不选;
c.容量瓶使用前未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故c不选;
d.使用的烧杯和玻璃棒未洗涤彻底,导致溶质的物质的量偏小,溶液浓度偏低,故d不选;
e.定容时将蒸馏水洒在容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故e不选;
故答案为:大于;a.
点评 本题考查了一定物质的量浓度溶液的配制,难度中等,注意从c=$\frac{n}{V}$理解溶液配制原理与误差分析,注意容量瓶的选择,为易错点.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题



 .
. (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | R | W | X | Y | Z |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 离子还原性:Y2-<Z- | B. | 离子半径W+>Z- | ||
| C. | 气态氢化物稳定性:RH4<XH4 | D. | 酸性:H2YO4<HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.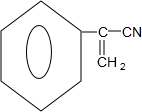 ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 0.25 mol | C. | 0.27 mol | D. | 0.52 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com