
【题目】石油经裂化、裂解得到基本化学原料。以有机物Y为主要原料合成一系列产品的流程如下:

已知:R-X![]() R-CN
R-CN![]() R-COOH(R代表烃基, X代表卤素原子)
R-COOH(R代表烃基, X代表卤素原子)
请回答下列问题:
(1)Y的系统命名是________。B中的官能团名称是________。
(2)反应⑦的反应类型是________。
(3)反应①的化学方程式为__________________。
(4)写出E与足量NaOH溶液反应的化学方程式__________________。
(5)Z是B的同分异构体,Z既能发生银镜反应,又能与金属钠反应,Z的结构共有________种 (不考虑立体异构);若Z分子中只有3种不同化学环境的氢原子,写出其发生银镜反应的化学方程式________。
【答案】 丙烯 羧基 酯化反应或取代反应 CH3CH=CH2+HBr→![]()
![]() +2NaOH
+2NaOH![]()
![]() +2CH3CH2OH 5
+2CH3CH2OH 5 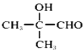 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
【解析】①![]() ,Y为丙烯与HBr加成生成A
,Y为丙烯与HBr加成生成A ,A与KCN发生取代反应生成
,A与KCN发生取代反应生成 ,水解产物酸化后生成B
,水解产物酸化后生成B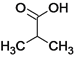 ,B再与溴发生取代生成
,B再与溴发生取代生成 ,
, 与KCN发生取代生成C
与KCN发生取代生成C ,C水解产物酸化后生成D
,C水解产物酸化后生成D ,⑦D与乙醇发生酯化反应生成E
,⑦D与乙醇发生酯化反应生成E 。
。
(1)Y的系统命名是丙烯。B 中的官能团名称是羧基。(2)反应⑦D与乙醇发生酯化生成E
中的官能团名称是羧基。(2)反应⑦D与乙醇发生酯化生成E ,反应类型是酯化反应或取代反应。(3)反应①
,反应类型是酯化反应或取代反应。(3)反应①![]() Y为丙烯与HBr加成生成A
Y为丙烯与HBr加成生成A ,化学方程式为 CH3CH=CH2+HBr→
,化学方程式为 CH3CH=CH2+HBr→![]() 。(4)E
。(4)E 与足量NaOH溶液反应生成钠盐和乙醇的化学方程式
与足量NaOH溶液反应生成钠盐和乙醇的化学方程式![]() +2NaOH
+2NaOH![]()
![]() +2CH3CH2OH 。(5)Z是B
+2CH3CH2OH 。(5)Z是B 的同分异构体,Z既能发生银镜反应,又能与金属钠反应,Z为羟基醛,分别为
的同分异构体,Z既能发生银镜反应,又能与金属钠反应,Z为羟基醛,分别为 、
、 、
、 、
、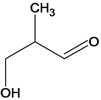 、
、 ,Z的结构共有5种(不考虑立体异构);若Z分子中只有3种不同化学环境的氢原子,该化合物为
,Z的结构共有5种(不考虑立体异构);若Z分子中只有3种不同化学环境的氢原子,该化合物为 ,其发生银镜反应的化学方程式
,其发生银镜反应的化学方程式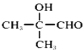 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O。
+2Ag↓+3NH3+H2O。


科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
__Fe(OH)3 +__ClO-+_OH-=_FeO42-+_Cl-+_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
实验一:探究亚硫酸与次氯酸的酸性强弱。选用的装置和药品如下。

![]() 装置A气密性检查的方法是________。
装置A气密性检查的方法是________。
![]() 装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
实验二:探究氯气与硫化氢气体混合能发生反应。选用的装置和药品如下。

![]() 通过现象________即可证明氯气与硫化氢发生了反应。
通过现象________即可证明氯气与硫化氢发生了反应。
![]() 该装置存在一个不妥之处,你的改进措施为________。
该装置存在一个不妥之处,你的改进措施为________。
实验三:探究氯元素和硫元素非金属性强弱。
![]() 为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
A.实验一能说明硫元素非金属性强于氯元素 B.实验二能说明硫元素非金属性弱于氯元素
C.通过测定盐酸和氢硫酸的pH来判断非金属性强弱 D.已知硫化氢的沸点为![]() ,氯化氢的沸点为
,氯化氢的沸点为![]() ,则硫元素非金属性强于氯元素
,则硫元素非金属性强于氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 明矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的碳原子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 1 molFe溶于过量硝酸,电子转移数为2NA
D. lmol FeI2与足量氯气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液aL分成两等份。一份加入bmolNaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3- 的浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com