


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“纳米碳”属于“纳米材料”,若将纳米碳均匀地分散到蒸馏水中,所形成的物质能透过滤纸,不能透过半透膜,静置后会析出黑色沉淀 |
| B、维生素C又称“抗坏血酸”,在人体内有重要的功能,是因为维生素C具有氧化性 |
| C、表面打磨过的铝箔,在空气中加热至熔化也不滴落是因为表面生成了熔点很高的氧化铝薄膜包裹在铝的外面 |
| D、科学家认为硅是“21世纪的能源”“未来石油”是因为自然界存在大量的硅单质,且可再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、测定过氧化氢的沸点 |
| B、测定过氧化氢分解时吸收的能量 |
| C、测定过氧化氢分子中的氢氧键与氧氧键键长 |
| D、观察过氧化氢细液流在电场中是否发生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
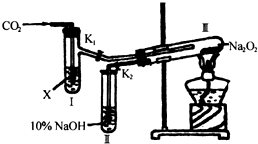 H2O2是无色液体,沸点比水高,不稳定、易分解生成H2O和O2.若向Na2O2中通入干燥CO2气体,Na2O2与CO2不反应.
H2O2是无色液体,沸点比水高,不稳定、易分解生成H2O和O2.若向Na2O2中通入干燥CO2气体,Na2O2与CO2不反应.
| ||
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市五校高一上学期期中联考化学试卷(解析版) 题型:选择题
把一定量铜粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+浓度恰好相等。则Cu2+和未反应的Fe3+的物质的量之比为
A.1:1 B.1:2 C.2:3 D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com