
| A. | 原溶液中投入铁粉物质的量是0.5mol | |
| B. | 原溶液中的HNO3浓度是2.0mol•L-1 | |
| C. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:1 | |
| D. | 反应后的溶液中还可以溶解16.0g铜 |
分析 溶液质量增重为参加反应Fe的质量与生成NO的质量之差,再根据电子转移守恒列方程计算溶液中n(Fe2+)、n(Fe3+),进而计算该题.
解答 解:生成NO的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
设生成Fe2+、Fe3+的物质的量分别为xmol、ymol,
由溶液质量增重18.6g,则:(x+y)mol×56g/mol-0.5mol×30g/mol=18.6g,
由电子转移守恒,则:2xmol+3ymol=0.5mol×3,
联立方程,解得x=0.3、y=0.3,
反应后c(Fe2+):c(Fe3+)为=0.3:0.3=1:1,
A.原溶液中投入铁粉物质的量是0.3mol+0.3mol=0.6mol,故A错误;
B.根据N元素守恒:n(HNO3)=2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.3mol+3×0.3mol+0.5mol=2mol,c(HNO3)=$\frac{2mol}{0.8L}$=2.5mol/L,故B错误;
C.由以上计算可知反应后的溶液中c(Fe2+):c(Fe3+)=1:1,故C正确;
D.由反应2Fe3++Cu=2Fe2++Cu2+可知,还可溶解0.15molCu,质量为0.15mol×64g/mol=9.6g,故D错误.
故选C.
点评 本题考查氧化还原反应的计算、氧化还原反应基本概念,为高频考点,侧重于学生的分析能力和计算能力的考查,利用电子转移守恒计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向稀硝酸中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[AI(OH)4]-+4NH4+ | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
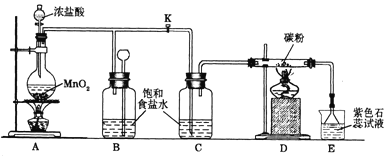
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
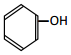 ②
②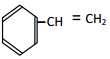 ③
③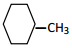 ④
④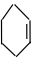 ⑤
⑤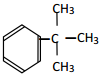 ⑥
⑥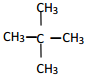
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的主要成分是氢氧化铝 | B. | CH3OH可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | Na2CO3可以做胃药 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com