
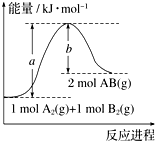
 图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )
图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )| A. | 每生成2 mol AB时吸收(a-b) kJ能量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键时放出a kJ能量 |
分析 由图象可知,反应物总能量小于生成物总能量,且反应热为△H=+(a-b) kJ•mol-1,以此解答该题.
解答 解:A.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,则每生成2molAB吸收(a-b) kJ热量,故A正确;
B.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJ•mol-1,故B正确;
C.由图象可知,该反应中反应物的能量低于生成物的能量,故C错误;
D.因旧键的断裂吸收能量,由图可知断裂1 mol A-A和1 mol B-B键吸收a kJ能量,故D错误;
故选AB.
点评 本题考查了化学反应的能量变化、图象分析判断,为高频考点,侧重于学生的分析能力的考查,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单,明确放热反应与吸热反应的区别是解题的关键.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
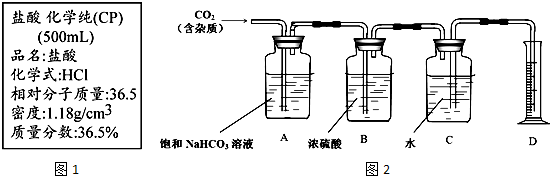
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
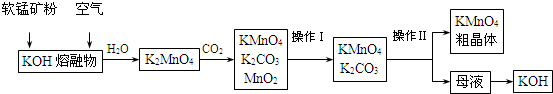
| 实验方法 | 实验现象及结论 |
| 取少量待测物于试管中,加水溶解后,滴加少量稀硫酸 | 出现无色气体溢出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
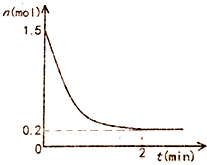 在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:
在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).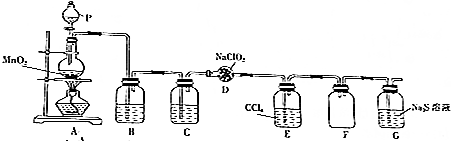
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上物质能导电的是④⑥⑩ | |
| B. | 以上物质属于电解质的是①②③④⑧⑨⑩ | |
| C. | 属于非电解质的是②⑤⑦ | |
| D. | 以上物质中,溶于水能够导电的物质是①②④⑤⑦⑧⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com