
亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如下:
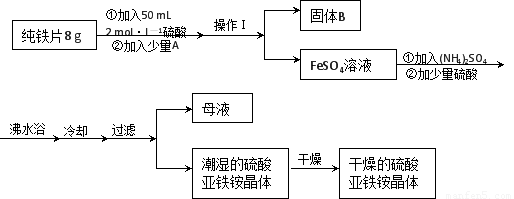
请回答下列问题:
(1)操作Ⅰ的名称是 ???????? ,所用主要仪器和用品有(铁架台、铁圈除外)??????????? 。
(2)若A物质为CuSO4,其加入的目的是???????????????? ,则固体B的成分为????????? 。
(3)加少量硫酸可以调节pH为 1~2,其作用是??????????????????????????????????????? 。
(1)过滤,(1分) 滤纸、漏斗、玻璃棒、烧杯(1分)
(2)加快铁片与硫酸的反应速率(1分)(其他合理答案也可)? Fe和Cu(2分)
(3)抑制Fe2+、NH4+水解(2分)
【解析】
试题分析:(1)根据题给工艺流程分析,操作Ⅰ为分离固液混合物的操作,名称是过滤,所用主要仪器和用品有(铁架台、铁圈除外)滤纸、漏斗、玻璃棒、烧杯;(2)若A物质为CuSO4,加入后和铁发生反应生成铜析出,和铁在硫酸溶液中形成原电池反应加快铁片与硫酸的反应速率,过滤得到固体B的成分为铁和铜的混合物;(3)加少量硫酸可以调节pH为 1~2,其作用是其加入的目的是抑制亚铁离子和铵根离子水解,得到更多的产品。
考点:考查物质的制备、分离,原电池原理的应用,盐类水解及阅读材料接受信息的能力。


科目:高中化学 来源:2013-2014学年湖北省高三上学期期末考试理综化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
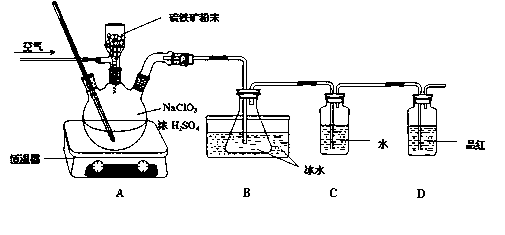
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:□ClO3- +□FeS2+□H+=□ClO2+□Fe3++□SO42-+□H2O
(2)装置D的作用是 。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:
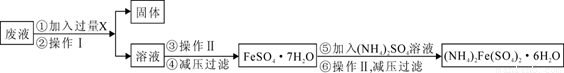
回答下列问题:
①操作Ⅰ的名称为: 。
②试剂X是 ,写出发生的主要反应的离子方程式 。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为 。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:实验题
亚铁盐中,FeSO4•7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4•FeSO4•6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4•FeSO4•6H2O。
实验室用废铁屑制备莫尔盐的过程如下:

(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组 设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
|
序号 |
实验方案 |
实验现象和结论 |
|
步骤1 |
取少量样品 |
样品颜色可能有变化。 |
|
步骤2 |
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 |
若 ,说明样品中含有FeSO4·7H2O杂质。 |
|
步骤3 |
若步骤2证明样品不含FeSO4•7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 |
若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
(已知(NH4)2SO4•FeSO4•6H2O的式量为392,(NH4)2SO4的式量为132)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com