
分析 过氧化钠与水反应生成氢氧化钠和过氧化氢,过氧化氢不稳定分解生成水和氧气,氧化还原反应的实质是电子转移,化合价降低元素所在的反应物是氧化剂,发生还原反应,元素失去电子化合价升高,化合价升高数=化合价降低数=转移电子数.
解答 解:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为: ,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,若2mol Na2O2与水反应,转移2mol电子,生成是1molO2,因为生成1mol的氧气需2mol的过氧化钠,而生成0.5mol O2需1mol的过氧化钠,答:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为:
,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,若2mol Na2O2与水反应,转移2mol电子,生成是1molO2,因为生成1mol的氧气需2mol的过氧化钠,而生成0.5mol O2需1mol的过氧化钠,答:第一步是Na2O2+2H2O=2NaOH+H2O2,第二步反应的化学方程式为:2H2O2 ═2H2O+O2↑,总的反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,电子转移方向和数目为: ,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,生成是1molO2,而生成0.5mol O2需1mol的过氧化钠.
,氧化剂是过氧化钠、还原剂是过氧化钠、氧化产物是氧气、还原产物是氢氧化钠,生成是1molO2,而生成0.5mol O2需1mol的过氧化钠.
点评 本题结合过氧化钠考查学生氧化还原反应中的基本概念知识,要求学生熟记教材知识,灵活应用.


科目:高中化学 来源: 题型:解答题
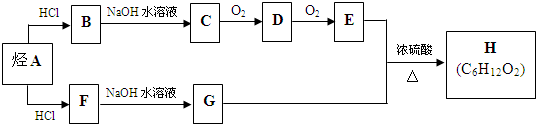
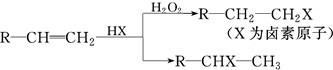
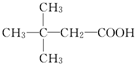 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中不可能含有离子键 | |
| B. | 只有金属元素和非金属元素才能形成离子键 | |
| C. | 水分子很稳定,因为水分子间存在氢键 | |
| D. | 所有的分子晶体内都存在两种以上作用力 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) 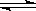 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
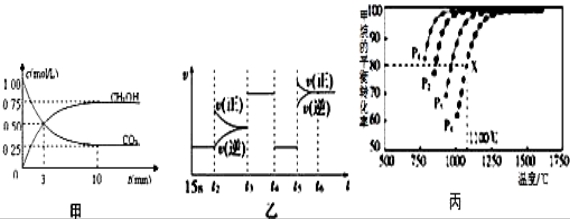
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使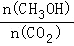 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的 条件是_____________.(填序号)
条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) 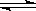 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
A、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的 转化率
转化率
B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C、在实验室里,可用碳酸钙粉末和稀盐酸制得二氧化碳气体;
D、实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)  2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2molSO2 1mol O2 | 1 mol SO2 0.5mol O2 | 2mol SO3 | 2mol SO2 2mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com