
某物质中可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:①有银镜反应 ②加入新制Cu(OH)2悬浊液,沉淀不溶解,③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,下列叙述中正确的是( )
|
| A. | 一定有甲酸乙酯和甲酸 |
|
| B. | 一定有甲酸乙酯和乙醇 |
|
| C. | 一定有甲酸乙酯,可能有甲醇 |
|
| D. | 几种物质都一定有 |
考点:
有机物的鉴别.
专题:
有机物的化学性质及推断.
分析:
甲酸、甲酸乙酯中含有醛基,可与银氨溶液或新制备氢氧化铜浊液发生氧化还原反应,其中甲酸具有酸性,可与氢氧化铜发生中和反应,甲酸乙酯可在碱性条件下发生水解反应,以此解答.
解答:
解:①有银镜反应,则可能为甲酸或甲酸乙酯;
②加入新制Cu(OH)2悬浊液,沉淀不溶解,说明不含甲酸;
③与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色,说明含有与氢氧化钠反应的物质,因不含甲酸,则一定含有甲酸乙酯,
题中没有涉及甲醇和乙醇的性质,不能确定是否含有,
则正确的只有C.
故选C.
点评:
本题考查有机物的鉴别,侧重于学生的分析能力和实验能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大,注意根据反应的现象进行判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源.该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电.关于该电池的下列说法不正确的是( )
|
| A. | 水既是氧化剂又是溶剂 |
|
| B. | 放电时正极上有氢气生成 |
|
| C. | 放电时OH﹣向正极移动 |
|
| D. | 总反应为:2Li+2H2O=2LiOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是()
A. 只有Fe2+和Cu2+
B. 一定有Fe2+、Cu2+,可能有Fe3+
C. 一定有Fe2+,可能有Cu2+
D. 只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 聚丙烯的结构简式: |
|
| B. | 丙烷分子的比例模型: |
|
| C. | 四氯化碳分子的电子式: |
|
| D. | 2﹣乙基﹣1,3﹣丁二烯分子的键线式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的结构简式为: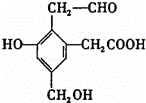 ,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
|
| A. | 6:4:5 | B. | 1:1:1 | C. | 3:2:3 | D. | 3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
|
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
|
| B. | 有机物2﹣溴丁烷的消去产物有两种 |
|
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH﹣COOCH3 |
|
| D. | 可用溴水鉴别1﹣己烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
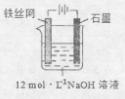
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变反应条件来改变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)+Br2(l)═2HBr(g);△H=﹣72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时 需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
|
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com