
分析 (1)摩尔质量在数值上等于其相对分子质量,单位是g/mol;
(2)根据m=nM来计算;
(3)根据公式V=nVm进行相应的计算;
(4)根据公式N=nNA=$\frac{m}{M}$NA来计算.
解答 解:(1)摩尔质量在数值上等于其相对分子质量,单位是g/mol,CH4的摩尔质量为16g/mol,故答案为:16g/mol;
(2)4.8gCH4的物质的量为$\frac{4.8g}{16g/mol}$=0.3mol,故答案为:0.3mol;
(3)根据V=nVm4.8gCH4在标准状况下的体积约为$\frac{4.8g}{16g/mol}$×22.4L/mol=6.72L,故答案为:6.72L;
(4)4.8gCH4的物质的量为$\frac{4.8g}{16g/mol}$=0.3mol,含有的氢原子数目是1.2NA,故答案为:1.2NA.
点评 本题考查学生有关物质的量以及阿伏伽德罗常数的计算等知识,属于综合知识的考查,难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
 羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题:
羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molN2含有NA个分子 | |
| B. | 标准状况下,22.4LCH4含有约4NA个氢原子 | |
| C. | 1molK2SO4溶于足量的水中后,溶液中含有2NA个K+ | |
| D. | 1molCH4比1molH2O的分子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 58.6% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L氦气中原子数为NA | |
| B. | 常温常压下,1.06gNa2CO3中阴离子电荷数为0.02NA | |
| C. | 标准状况下,22.4LCCl4中的分子个数为NA | |
| D. | 0.5mol/L的MgCl2溶液中的氯离子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 剩余固体一定有铜 | B. | 反应后的溶液呈蓝色 | ||
| C. | 剩余固体中一定有银 | D. | 反应后的溶液为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
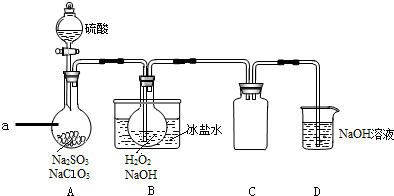
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个CHCl3分子所占的体积约为22.4L | |
| B. | 苯分子中的所有原子都在同一个平面上 | |
| C. | 点燃甲烷必须事先进行验纯 | |
| D. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com