
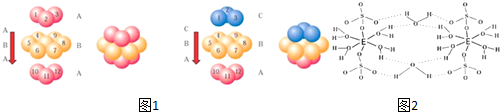
分析 A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,据此进行解答.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,
(1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1,则其基态原子的价电子排布式为:3d104s1,
故答案为:3d104s1;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N;
非金属性越强,其电负性越强,非金属性:O>N>C,则C、N、O三种元素的电负性大小为:O>N>C,
故答案为:C<O<N;O>N>C;
(3)B元素的最高价氧化物对应的水化物是碳酸,碳酸中中心原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,C原子杂化方式为sp2;
C为N元素,其氢化物是NH3,氨气分子中N原子价层电子对个数是4且含有1个孤电子对,VSEPR模型为四面体结构;
1个C2H4分子中含有5个σ键,1个1个π键,则lmolC2H4分子中含有5molσ键;
与CO2互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、阳离子、阴离子的化学式依次为:CS2、NO2+、SCN-或N3-,
故答案为:sp2;四面体; 5;CS2;NO2+;SCN-或N3-;
(4)E为铜元素,Cu为面心六方密堆积,为ABC型方式堆积,其其空间利用率为74%,
故答案为:ABC;74%;
(5)该盐为硫酸铜,根据图2可知,该化合物分子中含有5个结晶水分子,为无水硫酸铜;该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以以Cu为中心原子的配位键为: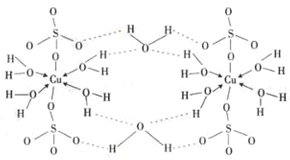 ,
,
故答案为:五水硫酸铜; .
.
点评 本题考查较为综合,涉及晶胞计算、原子核外电子排布、配位键、原子轨道杂化方式及类型、原子结构与元素周期律的应用等知识,题目难度中等,推断元素为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知 N2(g)+3H2 (g)═2NH3(g)△H=-92.4 kJ•mol-1,当有 1molNH3时,上述反应的△H 变为-46.2 kJ•mol-1 | |
| B. | 1mol 羟基(-OH)与 17gNH3所含电子数都为NA | |
| C. | 由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA | |
| D. | 常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
NaCl、NaClO、NaClO3的混合物中,已知Na的质量分数为23%,则氧元素的质量分数为
A.21.5% B.45.1% C.31.0% D.41.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com