
分析 (1)根据价层电子对互斥理论确定微粒空间构型,价层电子对数=σ键电子对数+中心原子上的孤电子对数;
(2)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,分子中心原子是sp杂化说明中心原子含有2个σ键且不含孤电子对;当中心原子形成3个σ键(含孤对电子),应为sp2杂化;中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4;同时含有三种不同杂化方式的碳原子,可以为同时含有烷、烯、炔结构;
(3)孤电子对间的排斥力大于孤电子对和成键电子对之间的排斥力;
(4)卤化银的卤族元素中,随着原子序数的增大阴离子半径逐渐增大,电子云变化越大,导致所形成的化合物在水中的溶解度越小.
解答 解:(1)BF3分子B原子含有3个σ键且不含孤电子对,所以空间构型是平面三角形,NF3分子中氮原子含有3个σ键且含有一个孤电子对,所以空间构型是三角锥型,
故答案为:平面三角形;三角锥型;
(2)CH3CH3中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,
CH2=CH2中含有单键和双键,既有σ键又有π键,分子中C原子含有3个σ键电子对,没有孤电子对,杂化类型为sp2,
CH≡CH中C原子杂化轨道数=σ键数+孤对电子对数=2+0=2,所以采取sp杂化,
苯中每个C原子形成3个σ键,不含孤电子对,为sp2杂化,
同时含有三种不同杂化方式的碳原子,可以为同时含有烷、烯、炔结构,如CH3CH2CH=CHC≡CH,
故答案为:CH≡CH;CH2=CH2、C6H6;CH3CH3;CH3CH2CH=CHC≡CH;
(3)由于氨气分子中含有一个孤电子对,水分子中含有2个孤电子对,对成键电子对的排斥作用增大,故键角逐渐减小,所以H2O、NH3、CH4分子中键角由大到小的顺序是CH4>NH3>H2O,
故答案为:由于氨气分子中含有一个孤电子对,水分子中含有2个孤电子对,对成键电子对的排斥作用增大,故键角逐渐减小;
(4)卤化银的卤族元素中,随着原子序数的增大阴离子半径逐渐增大,电子云变化越大,导致所形成的化合物在水中的溶解度越小,所以卤化银的溶解度大小顺序是AgF>AgCl>AgBr>AgI,
故答案为:AgF>AgCl>AgBr>AgI.
点评 本题考查了分子空间构型的判断、杂化类型判断、键角的判断、物质溶解性的判断等知识点,这些都是考试热点,会根据价层电子对互斥理论、电子对和孤电子对间的作用力来分析解答即可,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S,HCl,PH3的热稳定性由弱到强 | |
| B. | 物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大 | |
| C. | 等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多 | |
| D. | CH3CH2OH,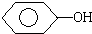 ,CH3COOH的酸性由弱到强 ,CH3COOH的酸性由弱到强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化镍高温分解 | B. | 电解熔融的氧化镍 | ||
| C. | 高温下用氢气还原氧化镍 | D. | 高温下用焦炭还原氧化镍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯从溴水中萃取溴、氯化钠潮解 | B. | 海水蒸馏制淡水、石油裂化 | ||
| C. | 碘的升华、煤的气化 | D. | 石油分馏得到汽油、SO2漂白草帽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中投入铁粉的物质的量是0.2mol | |
| B. | 原溶液中HNO3的浓度是1.5mol | |
| C. | 反应后的溶液中还可溶解7.2g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com