
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(g)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应
【答案】D
【解析】解:A.从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B.该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C.反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)= ![]() =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)=
=0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)= ![]() ×v(HCl)=
×v(HCl)= ![]() ×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
×0.03mol/(Lmin)=0.015mol/(Lmin),故C错误;
D.由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为: ![]() =0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡的计算,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】证明氨水是弱碱的事实是
A.氨水与硫酸发生中和反应B.氨水能使紫色石蕊试液变蓝
C.0.1 mol/L的NH4Cl溶液的pH值为5.1D.浓氨水易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化碳(CS2,标况下为液体)能够在氧气中完全燃烧生成CO2和SO2,今用0.228g CS2在448mL O2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
A. 112mL B. 224mL C. 336mL D. 448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y 和 Z 是原子序数依次递增的短周期元素。其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z 的最外层电子数之比为 2∶3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z 元素在元素周期表中的位置是______________ ,化合物 B2A4 的电子式为______________
(2)化合物A2X和A2Z中,沸点较高的是__________(填化学式),其主要原因是_____________
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为___________________, 由此可得出一氧化氮与ZX2的还原性大小关系为________________
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的离子方程式为:______________,并用单线桥标出此反应中电子转移的方向和数目。
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )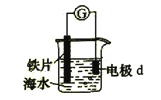
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验不合理的是( )
A.  蒸干NH4Cl饱和溶液制备NH4Cl晶体
蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.  实验室制备少量氨气
实验室制备少量氨气
C.  制备并观察氢氧化亚铁
制备并观察氢氧化亚铁
D. 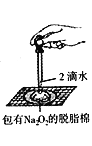 证明过氧化钠与水反应放热
证明过氧化钠与水反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中有很多物质可以实现下图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。

(1)若A是一种红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出反应①的化学方程式_______________________________________________。
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈浅绿色。
写出反应①的离子方程式________________________________________; 写出反应②的任意一个离子方程式____________________________________________。
(3)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液________(填“能”或“否”),若能,写出相应的离子方程式 (若否,则不用填此空)__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com