
| A. | v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | ||
| C. | 2 v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(H2) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、v正(N2)=v正(H2),未体现正与逆的关系,故A错误;
B、v正(N2)=v逆(NH3),速率之比不等于物质的量之比,故B错误;
C、2 v正(H2)=3 v正(NH3)=3 v逆(NH3),故C正确;
D、v正(N2)=v逆(H2),速率之比不等于物质的量之比,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O=H2SO4 | B. | CH2=CH2+HClO→CH3-CHOH | ||
| C. | CH3Cl+Cl2→CH2Cl2+HCl | D. | CO2+2NaOH=Na2CO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1盐酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1盐酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 实验现象 | 解释原因 |
 | 滴加硝酸银溶液,现象有:产生白色沉淀 | 原因有:氯气与水反应后,电离出Cl-,Cl-与Ag+生成AgCl白色沉淀 |
 | 滴加紫色石蕊试液,现象有:先变红,后褪色 | 原因有:氯气与水反应后,溶液显酸性使紫色石蕊试液变红,产生的HClO又使红色的石蕊试液发生漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如表各组物质中,不能通过一步反应实现如图所示转化的是( )
如表各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | NH4Cl | NH3 | NO |
| C | C | CO | CO2 |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
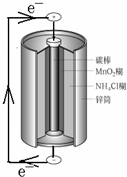
| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
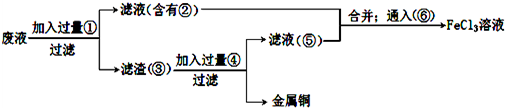
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com