
����Ŀ��X��Y��Z��R��M��ԭ�������������������Ԫ�أ���̬Xԭ�ӵ�s��������p��������3����Y��Zͬ���������ڣ���һ�����ܣ�Y��Z��Z��Rͬ���壬M���������29���˶�״̬����ش��������⣺
��1��������XCl3������ԭ���ӻ�����Ϊ___________��RCl2�����幹��Ϊ___________��
��2��H2Z��H2R�ķе�ֱ�Ϊ100����-60��4�����Խ�����ԭ��___________________��
��3��H2RO3��K1��K2�ֱ�Ϊ1��54��10-2��1��02��10-7������ݽṹ�����ʵĹ�ϵ����K1��K2��ԭ��___________________��
��4��Z��M�γɵ�һ�ֻ����ᄃ����ͼ��ʾ��
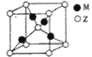
���û�����Ļ�ѧʽΪ________________��
������������Ϊapm����ʽ����þ������ܶ���=_____________gcm-3��
���𰸡���1��sp2V��
��2��H2O���Ӽ�����γ������H2S���Ӽ䲻���γ����
��3��SO32-��H+��Ľ������ǿ��HSO3-��H+��Ľ����������H2SO3��HSO3-����������ӣ�����̶ȴ�ӦKֵ��
��4����Cu2O ��![]()
�����������������X��Y��Z��R��M��ԭ������������������Ԫ�أ�M���������29���˶�״̬����MΪCu����̬Xԭ�ӵ�s��������p��������3����ԭ�Ӻ�������Ų�ʽΪ1s22s22p1����XΪBԪ�أ������ڱ���Y��Z�����ҵ�һ������Y��Z��Z��Rͬ���壬��Y�����������A�壬���ԭ��������֪����Y������A�壬R��ԭ����������Cu�����������⣬��YΪNԪ�ء�ZΪOԪ�ء�RΪSԪ�أ�
��1��������BCl3��Bԭ�ӹµ��Ӷ���=![]() =0���۲���Ӷ���=3+0=3��Bԭ�Ӳ�ȡsp2�ӻ���SCl2�۲���Ӷ���Ϊ
=0���۲���Ӷ���=3+0=3��Bԭ�Ӳ�ȡsp2�ӻ���SCl2�۲���Ӷ���Ϊ![]() =4���µ��Ӷ���Ϊ
=4���µ��Ӷ���Ϊ![]() =2�������ӻ�����Ϊsp3�ӻ�������ΪV�νṹ��
=2�������ӻ�����Ϊsp3�ӻ�������ΪV�νṹ��
��2��H2O���Ӽ�����γ������H2S���Ӽ䲻���γ��������ˮ�ķе������ߣ�
��3��SO32-��H+��Ľ������ǿ��HSO3-��H+��Ľ����������H2SO3��HSO3-����������ӣ�����̶ȴ�ӦKֵ��
��4���������к�ɫ��Ϊ4����ɫ����ĿΪ1+8��=2��ԭ����Ŀ֮��Ϊ2��1����Cu��O�γɵĻ�����ΪCu2O��
����������Ϊ2��![]() g�����ܶ�Ϊ2��
g�����ܶ�Ϊ2��![]() g����a��10-10cm��3=
g����a��10-10cm��3=![]() ��
��


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з�Ӧ�У�ֻ������õ��ǣ� ��
��������Ҵ���������Ӧ �ڱ���������Ӧ ����֬��ˮ�ⷴӦ �ܵ��۵�ˮ�ⷴӦ
A���٢� B���ڢ� C���ۢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ������Ȼ������Ļ�����Ҫ�ⶨ������Ԫ�ص�����������ʵ�鰴���²�����У�
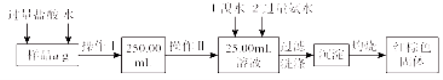
������������̣��ش��������⣺
��1�����������õ��IJ����������ձ����������⣬�������� �� �� (����������)
��2����д��������ˮ���������ӷ�Ӧ����ʽ ��
��3������������ȣ���ȴ�����£�����ƽ����������Ϊb1g���ٴμ��Ȳ���ȴ�����³���������Ϊb2g����b1-b2=0.3g�����������Ӧ���еIJ����� ���������������� W1 g������������Ⱥ������������W2g������Ʒ����Ԫ�ص����������� ����ͬѧ����������Բ������·������ⶨ��

���ܽ���Ʒ���������ᣬ���������ᣬԭ���� ��
��ѡ��Ļ�ԭ���Ƿ������� (��ǡ���)��ԭ���ǣ� ��
�����ζ��õ�c mol/ L KMnO4��ҺbmL������Ʒ����Ԫ�ص����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�㶨�¶��£����ݻ�Ϊ1L��������Ͷ��1mol CO��2mol H2O���������·�Ӧ��
CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ��ʱ����CO2 2/3mol���������¶Ⱥ��ݻ����䣬����������2mol H2O(g)��ʹ��Ӧ�����µ�ƽ�⣬����˵������ȷ����
CO2(g)+H2(g)��ƽ��ʱ����CO2 2/3mol���������¶Ⱥ��ݻ����䣬����������2mol H2O(g)��ʹ��Ӧ�����µ�ƽ�⣬����˵������ȷ����
A���¡���ƽ��ʱ�����������ѹǿ֮����5��3
B����ƽ��ʱH2O��ת����Ϊ20%
C����ƽ��ʱCO��Ũ����0.2 molL��1
D���¡���ƽ��ʱ�����������ܶ�֮��Ϊ5��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�Ԫ�����ڱ�˵������ȷ����( )
A. �ڵ���B�͵���B�帽�������ҵ����½�������
B. ����A�����к���������Σ�����ˮ���ʼ���
C. �����֪Ԫ�ص�����������Ϊ2���ɴ˲����жϸ�Ԫ�������ڱ��е�λ��
D. Ŀǰ��֪���ֵĵ���A��Ԫ��Ϊ5�֣����Ը���Ԫ�ع���5�ֵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH4I�����ܱ������У���һ���¶��·������з�Ӧ��
��NH4I(s)![]() NH3(g)��HI(g)����2HI(g)
NH3(g)��HI(g)����2HI(g)![]() H2(g)��I2(g)�ﵽƽ��ʱ��c(H2) =0.5mol��L-1��c(HI)=5mol��L-1������¶��·�Ӧ����ƽ�ⳣ��Ϊ
H2(g)��I2(g)�ﵽƽ��ʱ��c(H2) =0.5mol��L-1��c(HI)=5mol��L-1������¶��·�Ӧ����ƽ�ⳣ��Ϊ
A��36 B��30 C��25 D��20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Mn2O3�����ִ���ҵ��Ӧ�ù㷺��������ӵ�ص��Ʊ�������Ҫ�����á������̿�����Ҫ�ɷ�ΪMnO2�������̿�����Ҫ�ɷ�ΪMnS���Ʊ��ߴ���Mn2O3�Ĺ���������ͼ��ʾ��
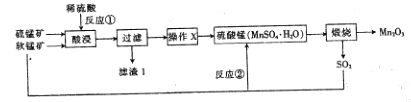
��1����Ӧ���л�����һ�ַǽ������ʣ���÷ǽ���������_________________���÷�Ӧ�Ļ�ԭ����________________�����ѧʽ��
��2������XΪ����Ũ����__________�����ˡ�ϴ�Ӻ�ɡ���ϴ�Ӳ����У����þƾ�ϴ��MnSO4��H2O���壬��ҪĿ����________________��
��3��Mn2O3��MnO2���ƣ�����ʱҲ����Ũ���ᷴӦ�ų�Cl2���÷�Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijλͬѧ���ü��зϾɲ���������һ����ʹ�������������������װ�ã���ͼ�������йظõ�ع���ʱ��˵����ȷ����( )
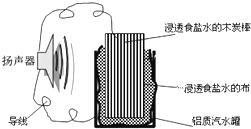
A��ľ̿��������ʴ
B����������Ϊ������ˮ�ޡ����ߡ�ʳ��ˮ�������������ߡ�̿��
C��ʳ��ˮ�е�Na����̿���ƶ�
D��̿���Ϸ����ķ�ӦΪ��2H����2e��=H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ����Ԫ�ص�������������һ��С��4
B. 1A��Ԫ���γɵĵ��ʵ��۵���ԭ�������ĵ���������
C. ͬ����������������ڵ�Ԫ��ԭ������֮�һ������18
D. �����Ļ�ѧ���ʱȵ������ã�������ǽ��������ʷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com